Poxel annonce son agenda financier 2018
Cours temps réel: 0,635 -2,61%| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
Agenda* financier 2020 de Poxel
• 12 février 2020 : Trésorerie et chiffre d’affaires 2019
• 26 mars 2020 : Résultats annuels 2019
• 21 avril 2020 : Trésorerie et chiffre d’affaires du 1er trimestre 2020
• 21 juillet 2020 : Trésorerie et chiffre d’affaires du 2e trimestre 2020
• 15 septembre 2020 : Résultats semestriels 2020
• 20 octobre 2020 : Trésorerie et chiffre d’affaires du 3e trimestre 2020
• 11 février 2021 : Trésorerie et chiffre d’affaires du 4e trimestre 2020
*Sujet à modification.
https://www.poxelpharma.com/fr/investisseurs/information-des-actionnaires/agenda-financier
|
Répondre
|
Poxel : annonce sa participation à la 3e conférence annuelle H.C. Wainwright sur la NASH
Communiqué de presse | 17/10/2019 | 17:46
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20191017005573/fr
------------------------------------------------------------------------------------
Regulatory News:
Poxel présentera ses deux programmes cliniques pour le traitement de la NASH
POXEL S.A. (Paris:POXEL) (Euronext : POXEL – FR0012432516), société biopharmaceutique spécialisée dans le développement de traitements innovants contre des maladies métaboliques, dont le diabète de type 2 et la stéatohépatite non alcoolique (NASH), annonce aujourd’hui sa participation à la 3e conférence annuelle de H.C. Wainwright (H.C. Wainwright 3rd Annual NASH Investor Conference), au cours de laquelle la Société présentera ses deux candidats médicaments en développement clinique pour le traitement de la NASH, le PXL770, un activateur direct de la protéine kinase activée par l'adénosine monophosphate (AMPK), et le PXL065, un inhibiteur du transporteur mitochondrial du pyruvate (MPC). Des résultats cliniques sur le PXL770 et le PXL065 sont attendus au 4e trimestre 2019.
La 3e conférence annuelle de H.C. Wainwright sur la NASH se tiendra le 21 octobre 2019 au St. Regis Hotel à New York. La Société présentera ses programmes dans la NASH le lundi 21 octobre 2019 de 16h00 à 16h20 (heure de New York).
La présentation dans le cadre de la conférence annuelle de H.C. Wainwright sur la NASH sera retransmise en direct sur internet et accessible grâce à ce lien. La retransmission en différé restera accessible pendant 90 jours après la présentation.
Deux études cliniques sur le PXL770 sont actuellement en cours. L’une est une étude de phase IIa évaluant l’efficacité et l’innocuité du PXL770 et dont les résultats sont attendus au 2e trimestre 2020. En parallèle, une étude clinique pharmacocinétique/pharmacodynamique (PK/PD) est en cours afin d’évaluer le profil pharmacocinétique complet du PXL770, ainsi que son effet pharmacodynamique sur les voies cibles et les paramètres métaboliques. Les résultats de cette étude sont attendus au 4e trimestre 2019.
Une étude de phase Ib à doses multiple et croissante sur le PXL065 est cours et les résultats sont attendus au 4e trimestre 2019. Cette étude vise à évaluer le profil de sécurité, la tolérance et la pharmacocinétique du PXL065 et contribuera à déterminer la dose pour le programme d’enregistrement.
À propos du PXL770
Le PXL770 est un activateur direct, premier de sa classe, de la protéine kinase activée par l’adénosine monophosphate (AMPK). L'AMPK a un rôle de régulateur métabolique ayant une fonction clé sur le métabolisme des lipides, l'homéostasie du glucose et l'inflammation. De par ce rôle clé, cibler l'AMPK offre l'opportunité de poursuivre un large éventail d'indications pour traiter les maladies métaboliques chroniques, y compris les maladies affectant le foie, comme la stéatohépatite non alcoolique (NASH)1.
À propos du PXL065
Le PXL065 est le stéréoisomère R de la pioglitazone stabilisée par substitution au deutérium. La pioglitazone est un médicament qui a fait l’objet des études les plus avancées pour le traitement de la NASH et a permis la « résolution de la NASH sans aggravation de la fibrose » dans un essai de phase IV2. La pioglitazone est le seul médicament recommandé par l’American Association for the Study of Liver Diseases (AASLD) et par la European Association for the Study of the Liver (EASL)3 dans les protocoles de traitement des cas de NASH avérés par biopsie. Toutefois, l’emploi de la pioglitazone a été restreint dans la NASH en raison des effets secondaires des PPARγ, dont la prise de poids, les fractures osseuses et la rétention hydrique.
La pioglitazone est un mélange, en proportions égales, de deux molécules miroirs (stéréoisomères R et S) qui s’interconvertissent in vivo. Par substitution au deutérium, nous sommes parvenus à stabiliser chaque stéréoisomère et à définir leurs propriétés pharmacologiques diamétralement opposées. Des études in vitro ont montré que le PXL065 est un inhibiteur ciblant le MPC. Des modèles précliniques ont mis en évidence l’action anti-inflammatoire du PXL065 et son efficacité dans la NASH avec peu ou pas de prise de poids ou de rétention hydrique, qui sont des effets secondaires associés au stéréoisomère S. Les résultats précliniques et de l’étude de phase I permettent de penser que le PXL065 aurait un profil thérapeutique supérieur à la pioglitazone dans le traitement de la NASH.
À propos de Poxel SA
Poxel est une société biopharmaceutique dynamique qui s’appuie sur son expertise afin de développer des traitements innovants contre les maladies métaboliques, dont le diabète de type 2 et la stéatohépatite non-alcoolique (NASH). La Société dispose actuellement d'un portefeuille de 3 produits à un stade de développement clinique intermédiaire à avancé ainsi que des opportunités à un stade plus précoce. L’Imeglimine, produit phare de Poxel et premier d’une nouvelle classe de médicaments, cible le dysfonctionnement mitochondrial. Avec son partenaire Sumitomo Dainippon Pharma, Poxel mène actuellement au Japon le programme de phase III TIMES dans le traitement du diabète de type 2. La Société a également établi un partenariat avec Roivant Sciences qui prend en charge le développement de l’Imeglimine et sa commercialisation aux États-Unis, en Europe et dans d’autres pays non couverts par le partenariat conclu avec Sumitomo Dainippon Pharma. Le PXL770, un activateur direct, premier de sa classe, de la protéine kinase activée par l’adénosine monophosphate (AMPK) avance dans son développement clinique avec le lancement d’un programme de phase IIa de preuve de concept pour le traitement de la NASH. Le PXL770 pourrait également traiter d’autres maladies métaboliques chroniques. Le PXL065 (R-pioglitazone stabilisée par substitution au deutérium), un inhibiteur du transporteur mitochondrial du pyruvate (Mitochondrial Pyruvate Carrier – MPC) est actuellement en phase I de développement clinique pour le traitement de la NASH. Poxel dispose également d’autres programmes à un stade plus précoce de développement dont des candidats médicaments deutérés pour le traitement de maladies métaboliques rares et de spécialité. La Société entend poursuivre son développement par une politique proactive de partenariats stratégiques et le développement de son portefeuille de candidats médicaments.
Poxel est cotée sur Euronext Paris, son siège social est situé à Lyon, en France, et la Société dispose de filiales à Boston aux États-Unis, et Tokyo au Japon.
Pour plus d’informations : www.poxelpharma.com
Toutes les déclarations autres que les énoncés de faits historiques inclus dans le présent communiqué de presse au sujet d'événements futurs sont sujettes à (i) des changements sans préavis et (ii) des facteurs indépendants de la volonté de la Société. Ces déclarations peuvent comprendre, sans s'y limiter, tout énoncé précédé, suivi ou incluant des mots tels que « cibler », « croire », « s'attendre à », « viser », « avoir l'intention de », « pouvoir », « prévoir », « estimer », « planifier », « projeter », « vouloir », « pouvoir avoir », « susceptible de », « probable », « devoir », « pouvoir » et d’autres mots et termes ayant un sens similaire ou la forme négative qui en découle. Les déclarations prospectives sont assujetties à des risques et à des incertitudes inhérents indépendants de la volonté de la Société qui pourraient conduire à ce que les résultats ou les performances réels de la Société diffèrent considérablement des résultats ou des performances attendus exprimés ou sous-entendus dans ces déclarations prospectives.
1 Smith B. K et al., (2016) Am J Physiol Endocrinol Metab 311, E730 – E740.
2 Cusi, et al., Ann Intern Med. 2016, 165(5), 305-315.
3 J Hepatol. 2016, 64(6),1388-402; Hepatology 2018, 67, 328-357.
|
Répondre
|
Concernant le CA çi-dessous...
Les chiffres étaient attendus en baisse en Ca prévisionnel : c'est conforme au plan de marche.
Et la trésorerie fait l'élastique à la baisse à cause de la poursuite des développements prometteurs en cours.
|
Répondre
|
Chiffre d'affaires et trésorerie S1-2019
|
Répondre
|
Poxel : Bilan semestriel du contrat de liquidité contracté avec ODDO Corporate Finance
15/07/2019 | 17:46 | Communiqué de presse
https://www.businesswire.com/news/home/20190715005554/fr/
--------------------------------------------------------------------------------------------
Au titre du contrat de liquidité confié par la société POXEL (Paris:POXEL) à ODDO Corporate Finance, à la date du 28 juin 2019, les moyens suivants figuraient au compte de liquidité :
• Nombre d’actions : 32 504 titres
• Solde en espèce du compte de liquidité : 118 935,66 €
Lors du dernier bilan semestriel, à la date du 31 décembre 2018, les moyens suivants figuraient au compte de liquidité :
• Nombre d’actions : 38 100 titres
• Solde en espèce du compte de liquidité : 78 080,26 €
Lors de la mise en œuvre de ce contrat, les moyens suivants figuraient au compte de liquidité :
• Nombre d’actions : 0 titre
• Solde en espèce du compte de liquidité : 250 000,00 €
À propos de Poxel SA
Poxel s’appuie sur son expertise de développement dans le métabolisme pour poursuivre le développement clinique de son portefeuille de candidats médicaments concentré sur le traitement des désordres du métabolisme, dont le diabète de type 2 et la stéato-hépatite non alcoolique (NASH). Nous avons mené à terme avec succès aux États-Unis, dans l’UE et au Japon, la phase II de développement de l’Imeglimine, notre produit phare, premier d’une nouvelle classe de médicaments, qui cible le dysfonctionnement mitochondrial. En partenariat avec Sumitomo Dainippon Pharma, nous réalisons actuellement au Japon le programme de phase III TIMES dans le traitement du diabète de type 2. Notre partenaire Roivant Sciences prend en charge le développement de l’Imeglimine et sa commercialisation aux États-Unis, en Europe et dans d’autres pays non couverts par le partenariat conclu avec Sumitomo Dainippon Pharma. Le PXL770, un activateur direct, premier de sa classe, de la protéine kinase activée par l’adénosine monophosphate (AMPK) avance dans son développement clinique avec le lancement d’un programme de phase IIa de preuve de concept pour le traitement de la NASH. Le PXL770 pourrait également traiter d’autres maladies métaboliques chroniques. Le PXL065 (R-pioglitazone stabilisée par substitution au deutérium), un inhibiteur du transporteur mitochondrial du pyruvate (Mitochondrial Pyruvate Carrier – MPC) est actuellement en phase I de développement pour le traitement de la NASH. Poxel dispose également d’autres programmes à un stade plus précoce de développement dont des candidats médicaments deutérés pour le traitement de maladies métaboliques rares et de spécialité. Poxel entend poursuivre son développement par une politique proactive de partenariats stratégiques et de développement de son portefeuille de candidats médicaments.
(Euronext : POXEL, www.poxelpharma.com)
|
Répondre
|
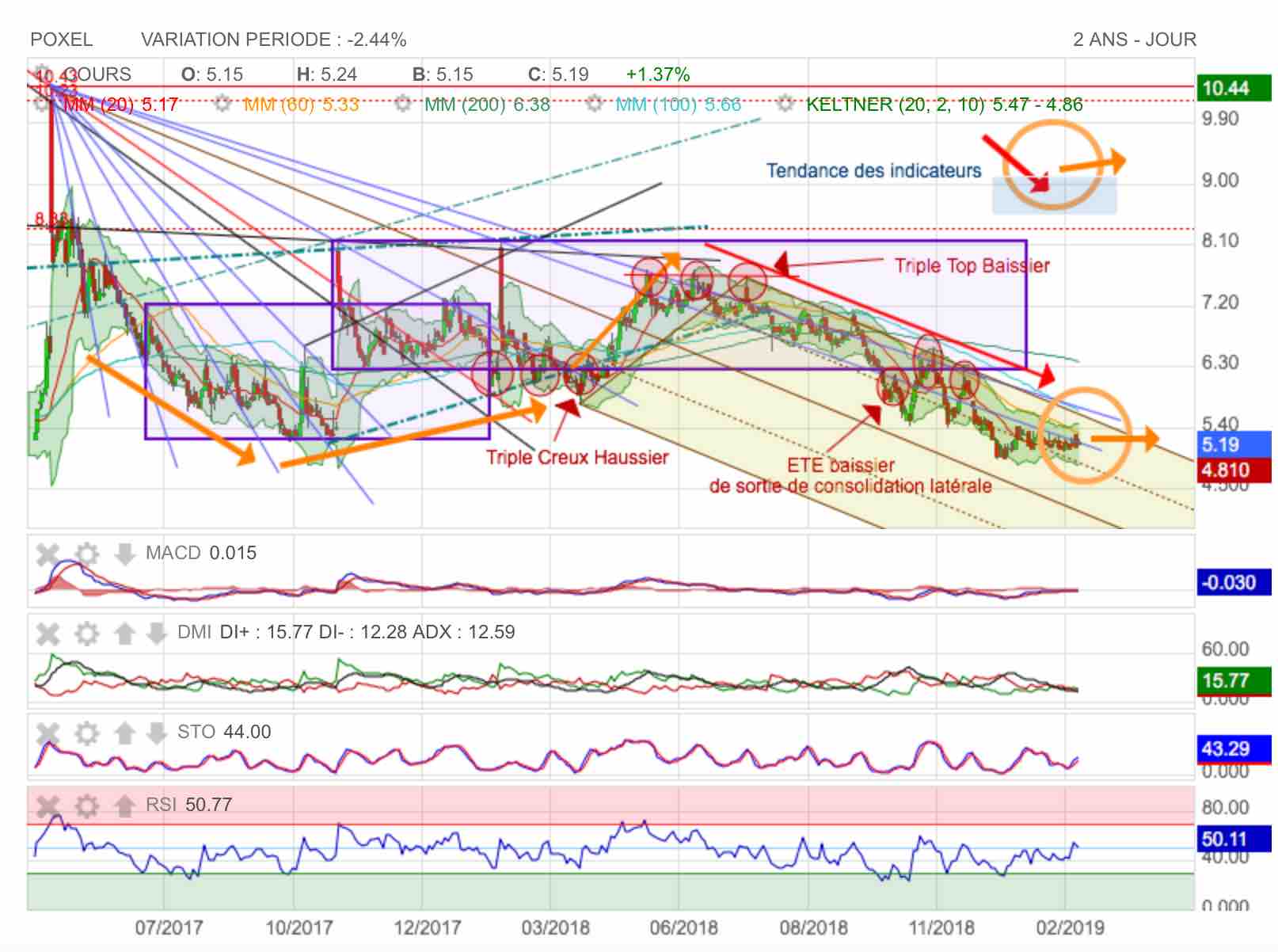
En attente d'un messi haussier qui devrait passer pour l'annonce du résultat net...
L'annonce du CA annuel n'a aucun effet ce jour ! La consommation de trésorerie doit inquiéter quant aux perspectives d'un exercice positive. Je pense cependant que les charges ont été anticipés au T1 et T2 pour lisser la Compta alors que les décaissement de trésoerie se sont fait essentiellement sur le second semestre.
J'ai fait une estimation de revenu net pour 2018 en post-précédent.
Et je pense donc que l'on va consolider latéralement en sortie de fourchette baissière en attendant la publication du résultat net le le 21 mars 2019. L'actualité sera chargé cette année et devrait reserver de bonnes surprises, vu que l'on arrive sur des possibles résultats positifs en phase III.
On notera qu'au 21 Mars en linéaire sur le niveau actuel : on est pile en buté sur la dernière dent de fourchette pour une sortie haussière.
A suivre donc !...
.
|
Répondre
|
Poxel publie son rapport financier pour le quatrième trimestre et l’exercice 2018
February 12, 2019 02:00 AM Eastern Standard Time
https://www.businesswire.com/news/home/20190211005656/fr/
_________________________________________________________________________
LYON, France--(BUSINESS WIRE)--Regulatory News
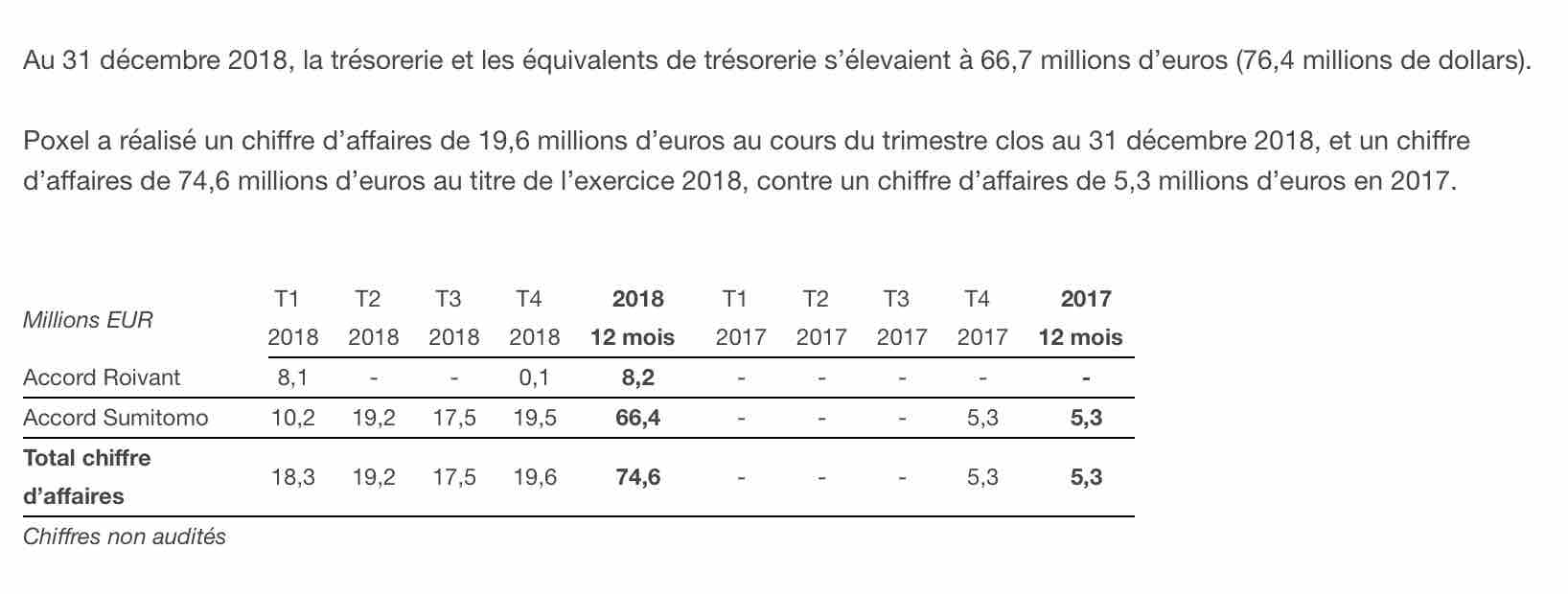
POXEL SA (Paris:POXEL) (Euronext – POXEL – FR0012432516), société biopharmaceutique spécialisée dans le développement de traitements innovants des maladies métaboliques, dont le diabète de type 2 et la stéatohépatite non alcoolique (NASH), publie aujourd’hui sa position de trésorerie et son chiffre d’affaires pour le quatrième trimestre 2018 et pour l’exercice clos au 31 décembre 2018.
Au 31 décembre 2018, la trésorerie et les équivalents de trésorerie s’élevaient à 66,7 millions d’euros (76,4 millions de dollars).
Poxel a réalisé un chiffre d’affaires de 19,6 millions d’euros au cours du trimestre clos au 31 décembre 2018, et un chiffre d’affaires de 74,6 millions d’euros au titre de l’exercice 2018, contre un chiffre d’affaires de 5,3 millions d’euros en 2017.
Ce chiffre comprend une partie du versement initial de 36 millions d’euros reçu de Sumitomo Dainippon Pharma dans le cadre du partenariat stratégique annoncé le 30 octobre 2017 et le versement initial de 35 millions de dollars (28 millions d’euros) reçu de Roivant Sciences dans le cadre du partenariat stratégique annoncé le 12 février 2018, net de la contribution financière de Poxel dans cet accord. Le chiffre d’affaires reflète également la refacturation à Sumitomo Dainippon Pharma des coûts encourus au cours de l’exercice 2018 dans le cadre du programme de développement de phase III de l’Imeglimine au Japon. Le paiement initial reçu de Sumitomo Dainippon Pharma et la refacturation des coûts de phase III Trials of IMeglimin for Efficacy and Safety (TIMES) sont comptabilisés selon l’avancement des coûts engagés dans ce programme.
« Je suis très heureux d’annoncer les progrès considérables réalisés en 2018 dans le développement de la Société : la signature d’un accord avec Roivant Sciences pour l’Imeglimine aux États-Unis, en Europe et dans les pays hors du périmètre de l’accord avec Sumitomo Dainippon Pharma ; la finalisation du recrutement des patients des trois études de phase III TIMES, avec plus de 1 100 patients recrutés au Japon ; la poursuite du développement du PXL770 pour le traitement de la NASH et l’acquisition du PXL065, un second programme au stade clinique pour le traitement de la NASH » déclare Thomas Kuhn, Directeur Geìneìral de Poxel.
« Cette année sera particulièrement importante pour l’Imeglimine. Nous prévoyons de publier au début du second trimestre 2019 les premiers résultats de TIMES 1, l’étude randomisée d’efficacité en monothérapie menée en double aveugle et versus placebo. Cette première publication devrait être suivie, à mi-année, de celle des premiers résultats de l’étude en association avec l’insuline, TIMES 3, après 16 semaines d’administration, randomisée, en double aveugle versus placebo. Les résultats de l’étude en association avec d’autres médicaments antidiabétiques existants, TIMES 2, ainsi que les résultats complets de TIMES 3 (après la période d'extension de 36 semaines en ouvert) devraient être publiés au cours du quatrième trimestre 2019.
Outre l’avancement du programme de phase III TIMES, nous poursuivons notre étroite collaboration avec notre partenaire Sumitomo Dainippon Pharma, en vue de soumettre le dossier d’enregistrement auprès des autorités japonaises en 2020 » ajoute Thomas Kuhn. « Pour les États-Unis et l’Europe, nous poursuivons notre étroite collaboration avec Roivant Sciences et Metavant, la filiale de Roivant Sciences dédiée au développement de candidats médicaments innovants pour le traitement des maladies métaboliques. Le développement clinique de l’Imeglimine ciblera dans un premier temps les patients diabétiques de type 2 souffrant d’insuffisance rénale chronique modérée aÌ sévère (stades 3b/4), dont une étude clinique dédiée est actuellement en cours. »
« Par ailleurs, notre étude de phase IIa pour le PXL770 dans le traitement de la NASH devrait démarrer au premier trimestre 2019. Nous prévoyons également d’initier au second semestre 2019 une étude de phase II pour le PXL065 dans le traitement de la NASH, à la suite des résultats de l’étude de phase I » poursuit Thomas Kuhn. « Nous avons renforcé notre présence dans le traitement de la NASH et sommes devenus l’une des rares sociétés de biotechnologies à mener de front deux programmes de développement clinique dans ce domaine thérapeutique. Les mécanismes pathophysiologiques sous-jacents qui conduisent au développement et à la progression de la NAFLD et de la NASH sont très complexes, et soutiennent la nécessité de développer des traitements innovants agissant sur différentes cibles. Nos deux programmes pourront potentiellement être utilisés en monothérapie, de manière combinée ou en association avec d’autres agents. »
Prochaines présentations de la Société :
• BIO Asia, du 5 au 6 mars 2019 à Tokyo, Japon
• 29e conférence annuelle Oppenheimer sur la santé, les 19 et 20 mars 2019 à New York
Prochain communiqué financier : Résultats annuels de l’exercice 2018, le 21 mars 2019
-----------------------------------------------------------------------------------------------------------------------
À propos de l’Imeglimine
Premier représentant d’une nouvelle classe chimique d’agents oraux, les Glimines, définies ainsi par l’Organisation Mondiale de la Santé, l’Imeglimine agit sur les trois principaux organes cibles impliqués dans l’homéostasie du glucose : le foie, les muscles et le pancréas. L’Imeglimine a un mécanisme d’action unique qui cible la bioénergétique mitochondriale. Il en découle un effet bénéfique potentiel sur la glycémie, ainsi que sur la prévention potentielle des dysfonctions endothéliale et diastolique, ce qui lui confère un effet protecteur contre les complications micro et macro vasculaires induites par le diabète. Les effets protecteurs potentiels de l’Imeglimine sur la survie et sur la fonction des cellules bêta, sont susceptibles de ralentir la progression de la maladie. Ce mécanisme d’action distinct de celui des traitements existants pour le diabète de type 2, fait de l’Imeglimine un candidat de choix en monothérapie et en complément d’autres traitements hypoglycémiants.
À propos du programme TIMES
TIMES (Trials of IMeglimin for Efficacy and Safety) est un programme de phase III de l’Imeglimine pour le traitement du diabète de type 2 au Japon et qui comprend trois études pivotales portant sur environ 1 100 patients. Le programme TIMES sera effectué avec une dose de 1 000 mg administrée deux fois par jour dans le cadre des trois études suivantes :
TIMES 1 : l’étude de phase III de 24 semaines, randomisée, en double aveugle versus placebo, vise à évaluer l’efficacité, l’innocuité et la tolérance de l’Imeglimine en monothérapie chez des patients japonais diabétiques de type 2. La baisse du taux d’hémoglobine glyquée HbA1c sera le critère principal d’évaluation. Les critères d’évaluation secondaires intègreront d’autres paramètres glycémiques et non glycémiques standard.
TIMES 2 : l’étude de phase III de 52 semaines en ouvert et en groupes parallèles, vise à évaluer l’innocuité et l’efficacité à long terme de l’Imeglimine chez des patients japonais diabétiques de type 2. Dans cette étude, l’Imeglimine sera administrée par voie orale en monothérapie ou en association avec des médicaments antidiabétiques existants, dont un inhibiteur de la DPP4, un inhibiteur des SGLT2, un biguanide, un sulfamide hypoglycémiant et un agoniste du récepteur GLP1.
TIMES 3 : l’étude de phase III de 16 semaines, randomisée, en double aveugle versus placebo, avec une période d’extension de 36 semaines, vise à évaluer l’innocuité et l’efficacité de l’Imeglimine en association avec l’insuline chez des patients japonais souffrant de diabète de type 2 associé à un contrôle glycémique insuffisant par insulinothérapie.
À propos du PXL770
Le PXL770 est un activeur direct, premier de sa classe, de la protéine kinase activée par l’adénosine monophosphate (AMPK). L'AMPK a un rôle de régulateur métabolique ayant une fonction clé sur le métabolisme des lipides, l'homéostasie du glucose et l'inflammation. De par ce rôle clé, cibler l'AMPK offre l'opportunité de poursuivre un large éventail d'indications pour traiter les maladies métaboliques chroniques, y compris les maladies affectant le foie, comme la stéato-hépatite non alcoolique (NASH)1.
À propos du PXL065
Le PXL065, anciennement le DRX-065, est le stéréoisomère R de la pioglitazone stabilisée par substitution au deutérium. La pioglitazone est un médicament qui a fait l’objet des études les plus avancées pour le traitement de la NASH et a permis la « résolution de la NASH sans aggravation de la fibrose » dans un essai de phase IV1. La pioglitazone est le seul médicament recommandé par l’American Association for the Study of Liver Diseases (AASLD) et par la European Association for the Study of the Liver (EASL) dans les protocoles de traitement des cas de NASH avérés par biopsie2. Toutefois, l’emploi de la pioglitazone a été restreint dans la NASH en raison des effets secondaires des PPARγ, dont la prise de poids, les fractures osseuses et la rétention hydrique.
La pioglitazone est un mélange, en proportions égales, de deux molécules miroirs (stéréoisomères) qui s’interconvertissent in vivo. Par substitution au deutérium, DeuteRx est parvenu à stabiliser chaque stéréoisomère et à définir leurs propriétés pharmacologiques diamétralement opposées. Des études in vitro ont montré que le PXL065 est un inhibiteur ciblant le MPC. Des modèles précliniques ont mis en évidence l’action anti-inflammatoire du PXL065 et son efficacité dans la NASH avec peu ou pas de prise de poids ou de rétention hydrique, qui sont des effets secondaires associés au stéréoisomère S. Les résultats précliniques et de l’étude de phase I permettent de penser que le PXL065 aurait un profil thérapeutique supérieur à la pioglitazone dans le traitement de la NASH.
À propos de Poxel SA
Poxel s’appuie sur son expertise de développement dans le métabolisme pour poursuivre le développement clinique de son portefeuille de candidats médicaments concentré sur le traitement des désordres du métabolisme, dont le diabète de type 2 et la stéatohépatite non alcoolique (NASH). Nous avons mené à terme avec succès aux États-Unis, dans l’UE et au Japon, la phase II de développement de l’Imeglimine, notre produit phare, premier d’une nouvelle classe de médicaments, qui cible le dysfonctionnement mitochondrial. En partenariat avec Sumitomo Dainippon Pharma, nous réalisons actuellement au Japon le programme de phase III TIMES dans le traitement du diabète de type 2. Notre partenaire Roivant Sciences prend en charge le développement de l’Imeglimine et sa commercialisation aux États-Unis, en Europe et dans d’autres pays non couverts par le partenariat conclu avec Sumitomo Dainippon Pharma. Le PXL770, un activateur direct, premier de sa classe, de la protéine kinase activée par l’adénosine monophosphate (AMPK) avance dans son développement clinique avec le lancement d’un programme de phase IIa de preuve de concept pour le traitement de la NASH. Le PXL770 pourrait également traiter d’autres maladies métaboliques chroniques. Le PXL065 (R-pioglitazone stabilisée par substitution au deutérium), un inhibiteur du transporteur mitochondrial du pyruvate (Mitochondrial Pyruvate Carrier – MPC) est actuellement en phase I de développement pour le traitement de la NASH. Poxel dispose également d’autres programmes à un stade plus précoce de développement dont des candidats médicaments deutérés pour le traitement de maladies métaboliques rares et de spécialité. Poxel entend poursuivre son développement par une politique proactive de partenariats stratégiques et de développement de son portefeuille de candidats médicaments.
(Euronext : POXEL, www.poxelpharma.com)
Sources :
1Smith B. K et al., (2016) Am J Physiol Endocrinol Metab 311, E730 – E740
2Cusi, et al., Ann Intern Med. 2016, 165(5), 305-315)
3J Hepatol. 2016, 64(6),1388-402; Hepatology 2018, 67, 328-357
Contacts
Poxel
Jonae R. Barnes
Senior Vice President, IR and Public Relations
jonae.barnes@poxelpharma.com
+1 617 818 2985
Relations Investisseurs / Média - Europe/US
Trophic Communications
Gretchen Schweitzer / Stephanie May
may@trophic.eu
+49 89 238 877 34 ou +49 171 185 56 82
Relations Investisseurs / Média - France
NewCap
Alexia Faure / Nicolas Merigeau
poxel@newcap.eu
+33 1 44 71 94 94
|
Répondre
|
Poxel : publie son agenda financier 2019
29/01/2019 | 17:46
POXEL SA (Euronext – POXEL – FR0012432516) (Paris:POXEL), société biopharmaceutique spécialisée dans le développement de traitements innovants des maladies métaboliques, dont le diabète de type 2 et la stéatohépatite non alcoolique (NASH), annonce aujourd'hui la publication de son agenda financier pour 2019.
Événement Date *
• Trésorerie et chiffre d’affaires 2018 12 février 2019
• Résultats annuels 2018 21 mars 2019
• Trésorerie et chiffre d’affaires du 1er trimestre 2019 8 avril 2019
• Trésorerie et chiffre d’affaires du 1er semestre 2019 15 juillet 2019
• Résultats semestriels 2019 26 août 2019
• Trésorerie et chiffre d’affaires du 3ème trimestre 2019 7 octobre 2019
• Trésorerie et chiffre d’affaires 2019 12 février 2020
(* Sous réserve de modification.)
Toutes les informations sur Poxel, tels que les rapports financiers ou les présentations, sont disponibles sur le site internet de la Société dans la rubrique « Investisseurs ».
|
Répondre
|
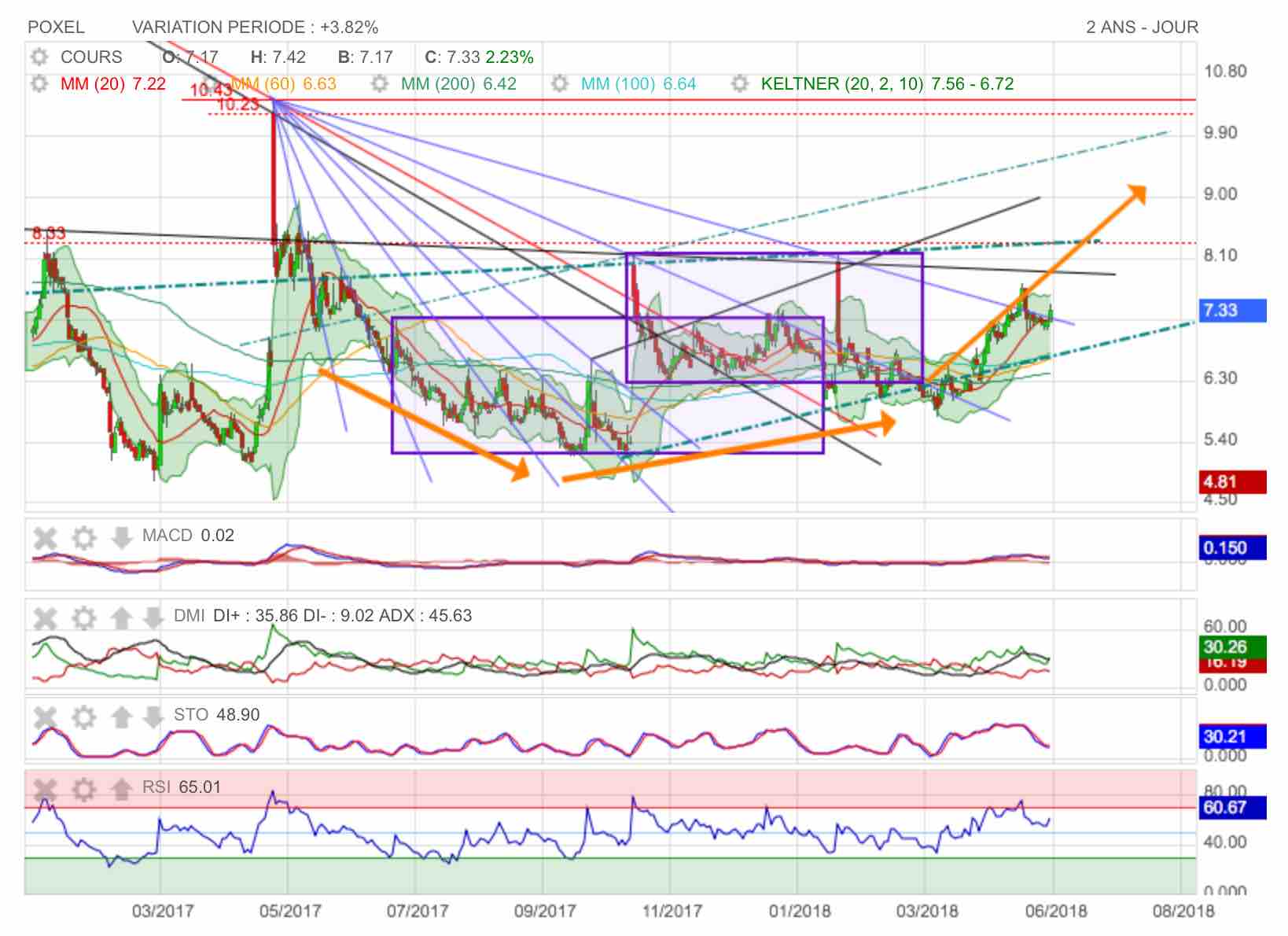
ET.... elle était super bien positioné !
A suivre à la hausse après la phase de consolidation actuelle.
.
|
Répondre
|
POXEL : perte nette de 22,3 millions d’euros en 2017
23/03/2018 | 08:51
Poxel annonce que sa trésorerie et équivalents de trésorerie s’établissaient à 53,4 millions d’euros (64,1 millions de dollars) au 31 décembre 2017. Ce chiffre ne comprend pas le versement initial, ni les investissements de Roivant Sciences, d’un montant de 50 millions de dollars (40 millions d’euros environ) en février 2018. La trésorerie de Poxel s'élevait à 34,9 millions d’euros. Elle a également dévoilé une perte nette de 22,3 millions d’euros, à comparer avec une perte de 24,5 millions d’euros en 2016.
Le chiffre d'affaires a atteint 5,3 millions d'euros (6,0 millions de dollars). Ce chiffre comprend une partie du versement initial de 36 millions d'euros reçu de Sumitomo Dainippon Pharma dans le cadre du partenariat stratégique annoncé le 30 octobre 2017 et la refacturation à Sumitomo Dainippon Pharma des coûts encourus au cours du quatrième trimestre dans le cadre du programme de développement de phase III de l'Imeglimine au Japon.
" Au cours de ces derniers mois, nous avons en outre réalisé des progrès considérables dans le développement de l'Imeglimine au Japon avec le lancement des trois études pivotales de phase III du programme TIMES. Conformément à notre plan, nous devrions obtenir les résultats de ces études de phase III en 2019, et ainsi soumettre en 2020 le dossier d'enregistrement de ce nouveau médicament auprès des autorités japonaises (PMDA). Aux États-Unis et en Europe, nous travaillons en étroite liaison avec Roivant Sciences dans l'objectif d'initier la phase III en 2019 " a déclaré Thomas Kuhn, Directeur Géneral de Poxel.
|
Répondre
|
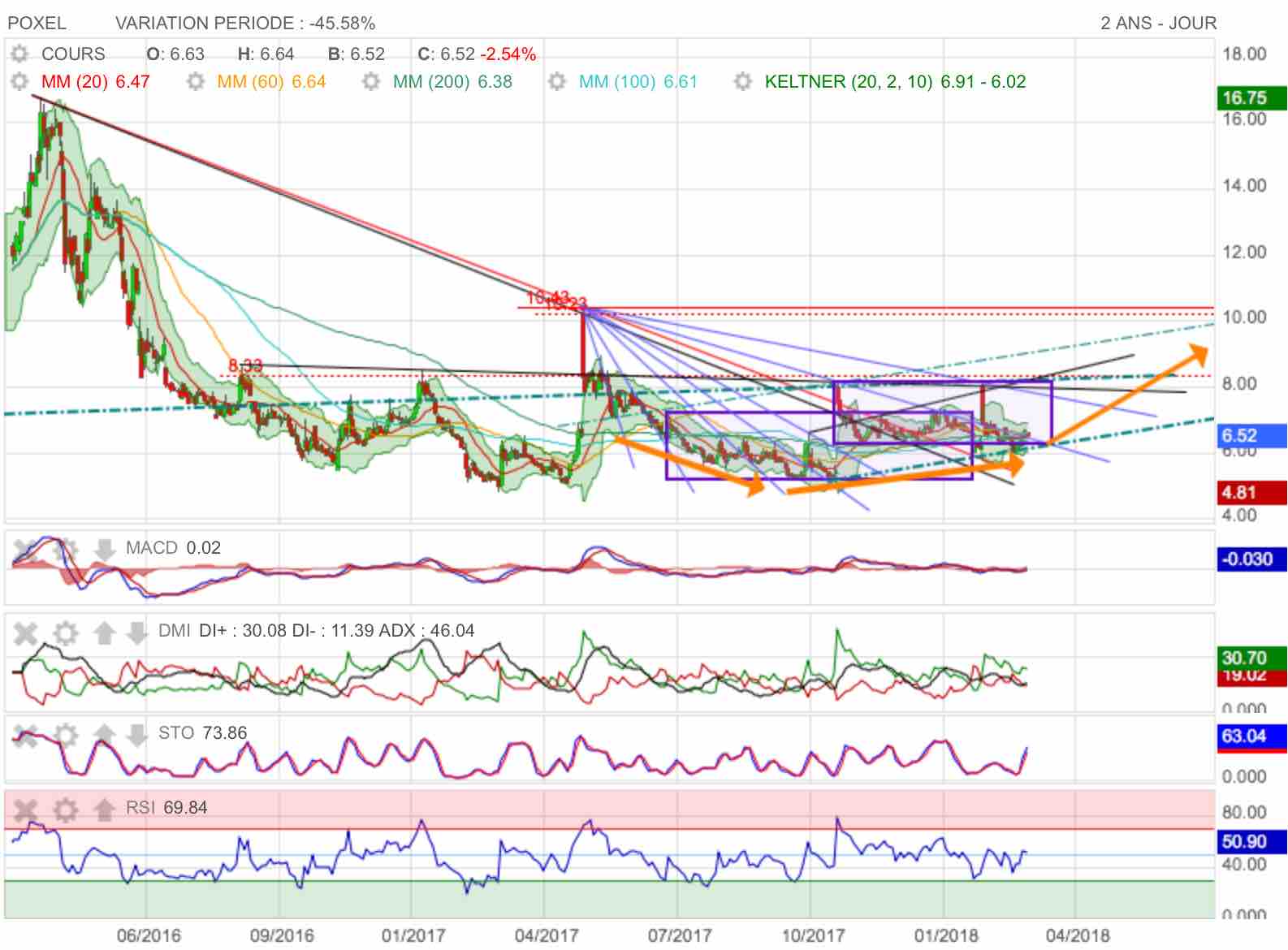
On observe depuis le mat haussier la formation d'un rateau haussier en bleu. On passe sucessivement les rayons d'abord baissiers pour normalement revenir au point de départ vers 10,00 / 10,50 euros.
La prochaine étape graphique sera le contact du prochain rayon bleu au dessus de 7,50 euros, celui qui coupe l'angle haut et à droite du cartouche de consolidation...
.
|
Répondre
|
Comptes annuels 2017 : 22 mars 2018
|
Répondre
|
Regulatory News:
http://cts.businesswire.com/ct/CT?id=smartlink&url=http%3A%2F%2Fwww.poxel.com%2F&esheet=51732007&newsitemid=20171218005708&lan=fr-FR&anchor=POXEL+SA&index=1&md5=62819a98a8c0ae4ee5ee9d355b9c38c9">POXEL SA (Paris:POXEL) (Euronext - FR0012432516, éligible PEA-PME), société biopharmaceutique spécialisée dans le développement de traitements innovants contre les maladies métaboliques, et notamment le diabète de type 2, annonce aujourd’hui son agenda financier 2018.
| Événement | Date * | |
| Trésorerie et revenus 2017 | 22 janvier 2018 | |
| Comptes annuels 2017 | 22 mars 2018 | |
| Trésorerie et revenus 1er trimestre 2018 | 23 avril 2018 | |
| Trésorerie et revenus 1er semestre 2018 | 10 juillet 2018 | |
| Comptes semestriels 1er semestre 2018 | 19 septembre 2018 | |
| Trésorerie et revenus 3ème trimestre 2018 | 16 octobre 2018 | |
| Trésorerie et revenus 2018 | 22 janvier 2019 |
* Sous réserve de modification.
À propos de Poxel - http://cts.businesswire.com/ct/CT?id=smartlink&url=http%3A%2F%2Fwww.poxel.com&esheet=51732007&newsitemid=20171218005708&lan=fr-FR&anchor=www.poxel.com&index=2&md5=17f4362c8c0c8e3e1ea71c1832ddbd88">www.poxel.com
Poxel s’appuie sur son expertise de développement dans le métabolisme pour développer et valoriser un portefeuille de candidats médicaments, concentré actuellement sur le diabète de type 2. Nous avons terminé le développement de phase 2 aux États-Unis, en Europe et au Japon de notre produit le plus avancé, l’Imeglimine, premier d’une nouvelle classe thérapeutique ciblant le dysfonctionnement mitochondrial. Nous poursuivons le développement de notre 2e programme, le PXL770, un activateur direct de l’AMPK. Nous entendons poursuivre notre croissance grâce à des partenariats stratégiques et le développement de notre portefeuille.
http://cts.businesswire.com/ct/CT?id=bwnews&sty=20171218005708r1&sid=9430&distro=ftp" />
Consultez la version source sur businesswire.com : http://www.businesswire.com/news/home/20171218005708/fr/">http://www.businesswire.com/news/home/20171218005708/fr/
© Business Wire
|
Répondre
|

 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !