Pharming group
Cours temps réel: 0,881 1,50%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Forum |
communiqué de presse26 novembre
Pharming Group dépose publiquement une déclaration d'enregistrement auprès de la SEC des États-Unis pour faciliter l'inscription des ADS représentant des actions ordinaires sur le marché mondial du Nasdaq
Pharming Group NV, une société biopharmaceutique mondiale au stade commercial développant des thérapies innovantes de remplacement de protéines et des médicaments de précision pour le traitement des maladies rares et des besoins médicaux non satisfaits, annonce aujourd'hui qu'elle a publiquement déposé une déclaration d'enregistrement auprès de la Securities and Exchange Commission des États-Unis (la " SEC ") dans le cadre d'une proposition de cotation d'American Depositary Shares (" ADS ") représentant les actions ordinaires de la Société d'une valeur nominale de 0,01 € chacune (" Actions Ordinaires ") sur le Nasdaq Global Market (" Nasdaq ").
|
Répondre
|
On devrait aller chercher les 1,40 si le climat économique ne se dégrade pas trop.
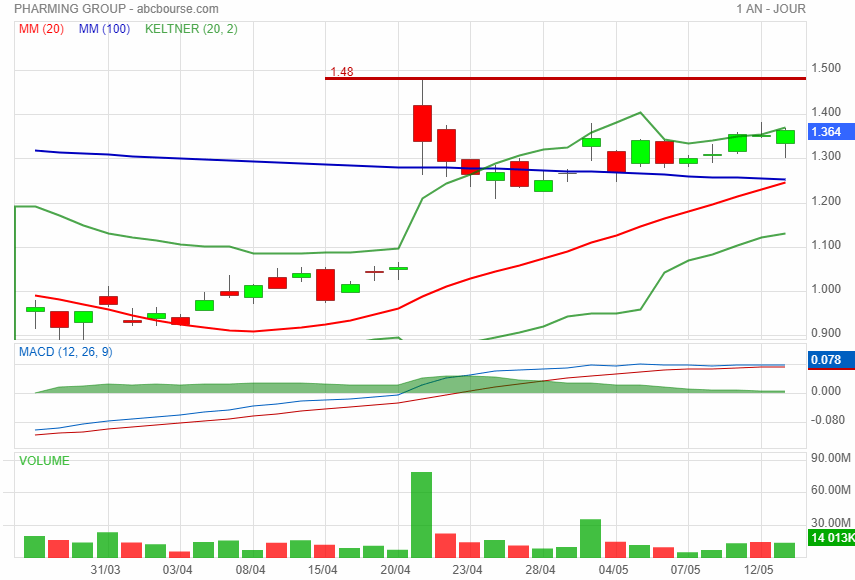
|
Répondre
|
La tendance reste haussière même avec des indices US défavorables.
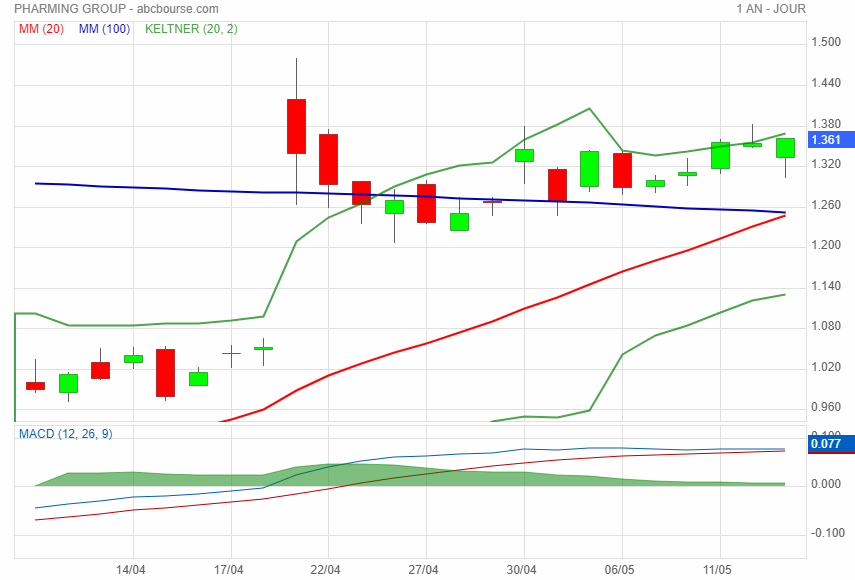
|
Répondre
|
Bien entouré, les acheteurs ont la main.
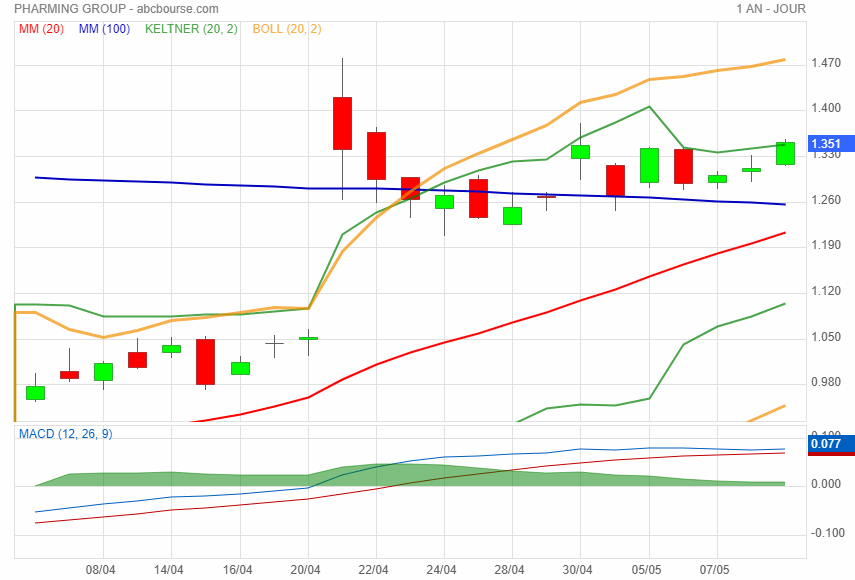
|
Répondre
|
"Après le traitement par Ruconest, la fièvre a disparu chez quatre des cinq patients dans les 48 heures, et les marqueurs de laboratoire de l'inflammation ont diminué de manière significative", indique le laboratoire. Ils ont pu rentrer chez eux. Le cinquième patient a été transféré à l'unité de soins intensifs pour être intubé, mais il s'est rétabli par la suite. Désormais, un essai clinique multinational, randomisé, sera lancé sur 150 patients. L'étude sera dirigée par le Dr Michael Osthoff, de l'hôpital universitaire de Bâle, qui a indiqué "bien qu'il s'agisse d'une petite expérience de traitement non contrôlée, les résultats démontrent l'efficacité potentielle de l'utilisation de Ruconest comme approche anti-inflammatoire pour inhiber les systèmes du complément et du contact après une infection par le SRAS-CoV-2".
|
Répondre
|
Five patients from ages 53-85 suffering from severe pneumonia caused by COVID-19 were treated with Ruconest. Obviously, they were already hospitalised when treatment started. Initially, they were treated with hydroxychloroquine and lopinavir/ritonavir, but this was ineffective. Four out of the five patients showed signs of improvement after the Ruconest treatment, however, one of them was admitted to the Intensive Care, fortunately, he or she recovered in the following days. With an average age of 69, a 20% flow rate to the ICU is promising. From data of the CDC, people aged 65-75 were brought to the ICU 20%-66% of the time after they were hospitalised, this is calculated by dividing the ICU admission rate by the hospitalization rate. From the little trial we currently have available, it seems Ruconest's treatment is promising for critical COVID-19 patients.
(I will explain how the 20%-66% flow rate is calculated. The idea is to divide the ICU admission rate with the hospitalization rate to attain the flow rate to the ICU. Since the CDC is giving ranges it's most appropriate to calculate the best and worst case. The best-case scenario is 8.1%/43.5% = 20% and the worse-case scenario is 18.8%/28.6%=66%. The data can be checked from reading the tables below.)
Message complété le 30/04/2020 12:48:19 par son auteur.
Pharming Group Might Have An Effective COVID-19 Treatment Ready For Use
Message complété le 30/04/2020 12:53:34 par son auteur.
PAS Traduit avec www.DpL.com/Translator (version gratuite)
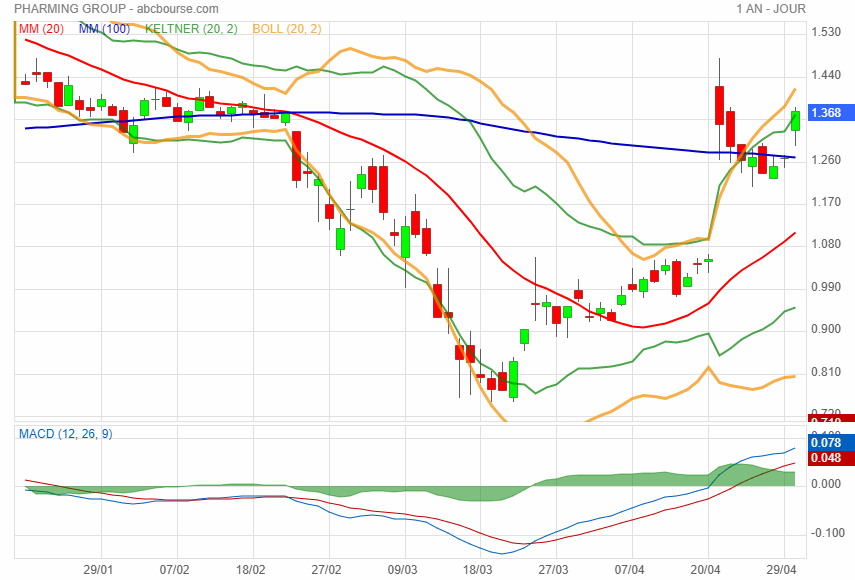
|
Répondre
|
C'est une très bonne nouvelle pour Pharming. Le succès des études sur le tocilizumab montrent que la stratégie visant à agir sur la cascade de l'inflammation est la bonne. La C1 esterase de Pharming agit plus en amont sur la cascade de l'inflammation que le tocilizumab. Les perspectives sont potentiellement considérables sur plusieurs pathologies réanimatoires: covid, sepsis...
|
Répondre
|
Pharming reports encouraging results from use of
RUCONEST® in COVID-19 patients
• Five hospitalised patients with confirmed COVID-19 infections administered RUCONEST® under
compassionate use program to treat the related severe pneumonia
• Multinational, randomized controlled, investigator-initiated study with up to 150 patients
planned
Leiden, The Netherlands, 21 April, 2020: Pharming Group N.V. (“Pharming” or “the Company”)
(Euronext Amsterdam: PHARM) today announced encouraging results from five patients with
confirmed COVID-19 (SARS-CoV-2) infections hospitalised with related severe pneumonia that were
treated with RUCONEST® (recombinant human C1 inhibitor) under a compassionate use program at the
University Hospital Basel, Switzerland.
Four male patients and one female patient (between 53-85 years of age) with COVID-19 and suffering
from related severe pneumonia, who did not improve despite standard treatment, including
hydroxychloroquine and lopinavir/ritonavir, were administered RUCONEST® at an initial dose of 8400
U, followed by 4200 U every 12 hours for three additional doses. No allergic reactions or drug related
adverse events were reported.
Following treatment with RUCONEST®, fever resolved in four of the five patients within 48 hours, and
laboratory markers of inflammation decreased significantly (CRP, IL-6). Soon thereafter, the patients
were discharged from the hospital as fully recovered. One patient had increased oxygen requirement
and was temporarily transferred to the ICU for intubation, but over the subsequent daysrecovered and
was released from the ICU.
Following these initial results, a multinational, randomized, controlled, investigator-initiated clinical
trial with up to 150 patients with confirmed COVID-19 infections, requiring hospitalisation due to
significant COVID-19 related symptoms is planned. The study will be led by Dr. Michael Osthoff,
University Hospital Basel, Switzerland.
Dr. Michael Osthoff, University Hospital Basel, Switzerland and the treating physician, said:
“Although this is an uncontrolled, small treatment experience, the results demonstrate the potential
effectiveness of using RUCONEST® as an anti-inflammatory approach to inhibit the complement and
contact systems after SARS-CoV-2 infection. We are now in the midst of planning a multinational,
randomized controlled trial in up to 150 patients to further understand the safety and efficacy of this
approach in preventing deterioration in COVID-19 patients.”
Prof. Bruno Giannetti, Pharming’s Chief Medical Officer, commented:
“Some of the dangerous biochemical processes occurring during the worsening of a COVID-19 infection
towards life-threatening pneumonia are likely triggered by complement activation as part of a systemic
hyperinflammatory syndrome, otherwise known as a ‘cytokine storm’. C1 inhibitor has numerous anti-
2
inflammatory properties, including inhibition of the complement and contact systems. A compassionate
treatment in a few patients suffering from COVID-19 pneumonia was, therefore,scientifically sound and
these preliminary results are very encouraging. Amongst others, we need to better identify the best time
point to start RUCONEST® treatment and the optimal dosing regimen. The planned multinational study
under the leadership of the University of Basel is aimed at providing this information.”
--o--
About Pharming Group N.V.
Pharming is a specialty pharmaceutical company developing innovative products for the safe,
effective treatment of rare diseases and unmet medical needs. Pharming’s lead product, RUCONEST®
(conestat alfa) is a recombinant human C1 esterase inhibitor approved for the treatment of acute
Hereditary Angioedema (“HAE”) attacks in patients in Europe, the US, Israel and South Korea. The
product is available on a named-patient basis in other territories where it has not yet obtained
marketing authorisation.
RUCONEST® is commercialised by Pharming in the US and in Europe, and the Company holds all other
commercialisation rights in other countries not specified below. In some of these other countries
distribution is made in association with the HAEi Global Access Program (GAP). RUCONEST® is
distributed in Argentina, Colombia, Costa Rica, the Dominican Republic, Panama, and Venezuela by
Cytobioteck, in South Korea by HyupJin Corporation and in Israel by Kamada.
RUCONEST® is also being evaluated for various additional indications. Pharming’s technology platform
includes a unique production process that has proven capable of producing industrial quantities of
pure high quality recombinant human proteins in a more economical and less immunogenic way
compared with current cell-line based methods.
Leads for enzyme replacement therapy (“ERT”) for Pompe and Fabry’s diseases are also being
produced and optimised respectively at present.
Pharming has recently in-licensed leniolisib from Novartis, a small molecule and selective PI3Kδ
inhibitor, which is in a registrational study for activated PI3K-delta syndrome (APDS), a rare form of
Primary Immunodeficiency.
Pharming has a long term partnership with the China State Institute of Pharmaceutical Industry
(“CSIPI”), a Sinopharm company, for joint global development of new products, starting with
recombinant human Factor VIII for the treatment of Haemophilia A. Preclinical development and
manufacturing will take place to global standards at CSIPI and its affiliates and are funded by CSIPI.
Clinical development will be shared between the partners with each partner taking the costs for their
territories under the partnership.
Forward-looking Statements
This press release of Pharming Group N.V. and its subsidiaries (“Pharming”, the “Company”) may
contain forward-looking statements including without limitation those regarding Pharming’s financial
projections, market expectations, developments, partnerships, plans, strategies and capital
expenditures.
The Company cautions that such forward-looking statements may involve certain risks and
uncertainties, and actual results may differ. Risks and uncertainties include without limitation the effect
of competitive, political and economic factors, legal claims, the Company’s ability to protect intellectual
property, fluctuations in exchange and interest rates, changes in taxation laws or rates, changes in
3
legislation or accountancy practices and the Company’s ability to identify, develop and successfully
commercialise new products, markets or technologies.
As a result, the Company’s actual performance, position and financial results and statements may differ
materially from the plans, goals and expectations set forth in such forward-looking statements. The
Company assumes no obligation to update any forward-looking statements or information, which
should be taken as of their respective dates of issue, unless required by laws or regulations.
For further public information, contact:
Sijmen de Vries, CEO: T: +31 71 524 7400
Susanne Embleton, Investor Relations Manager: +31 71 524 7400
FTI Consulting
Victoria Foster Mitchell / Mary Whittow, T: +44 203 727 1000
LifeSpring Life Sciences Communication, Amsterdam, The Netherl
|
Répondre
|
message originale
Pharming reports encouraging results from use of RUCONEST® in COVID-19 patients
Pharming announces encouraging results from five patients with confirmed COVID-19 (SARS-CoV-2) infections hospitalised with related severe pneumonia that were treated with RUCONEST® (recombinant human C1 inhibitor) under a compassionate use program at the University Hospital Basel, Switzerland.
Five hospitalised patients with confirmed COVID-19 infections administered RUCONEST® under compassionate use program to treat the related severe pneumonia
Multinational, randomized controlled, investigator-initiated study with up to 150 patients planned
Four male patients and one female patient (between 53-85 years of age) with COVID-19 and suffering from related severe pneumonia, who did not improve despite standard treatment, including hydroxychloroquine and lopinavir/ritonavir, were administered RUCONEST® at an initial dose of 8400 U, followed by 4200 U every 12 hours for three additional doses. No allergic reactions or drug related adverse events were reported.
Following treatment with RUCONEST®, fever resolved in four of the five patients within 48 hours, and laboratory markers of inflammation decreased significantly (CRP, IL-6). Soon thereafter, the patients were discharged from the hospital as fully recovered. One patient had increased oxygen requirement and was temporarily transferred to the ICU for intubation, but over the subsequent days recovered and was released from the ICU.
Following these initial results, a multinational, randomized, controlled, investigator-initiated clinical trial with up to 150 patients with confirmed COVID-19 infections, requiring hospitalisation due to significant COVID-19 related symptoms is planned. The study will be led by Dr. Michael Osthoff, University Hospital Basel, Switzerland.
Although this is an uncontrolled, small treatment experience, the results demonstrate the potential effectiveness of using RUCONEST® as an anti-inflammatory approach to inhibit the complement and contact systems after SARS-CoV-2 infection.
|
Répondre
|
ca va booster severe
21 avril 2020 Pharming rapporte des résultats encourageants de l'utilisation de RUCONEST® chez les patients COVID-19
Pharming annonce des résultats encourageants pour cinq patients atteints d'infections confirmées au COVID-19 (SARS-CoV-2) hospitalisés pour une pneumonie grave connexe qui ont été traités avec RUCONEST® (inhibiteur C1 humain recombinant) dans le cadre d'un programme d'utilisation compassionnelle à l'hôpital universitaire de Bâle, en Suisse.
Cinq patients hospitalisés avec des infections confirmées au COVID-19 ont reçu RUCONEST® dans le cadre d'un programme d'utilisation compassionnelle pour traiter la pneumonie sévère associée
Étude multinationale, randomisée, contrôlée et initiée par l'investigateur avec jusqu'à 150 patients prévus
Quatre patients de sexe masculin et une patiente (entre 53 et 85 ans) atteints de COVID-19 et souffrant d'une pneumonie grave connexe, qui ne se sont pas améliorés malgré le traitement standard, y compris l'hydroxychloroquine et le lopinavir / ritonavir, ont reçu RUCONEST® à la dose initiale de 8400 U, suivi de 4200 U toutes les 12 heures pour trois doses supplémentaires. Aucune réaction allergique ou événement indésirable lié au médicament n'a été signalé.
Après le traitement par RUCONEST®, la fièvre a disparu chez quatre des cinq patients dans les 48 heures et les marqueurs de laboratoire de l'inflammation ont diminué de manière significative (CRP, IL-6). Peu de temps après, les patients sont sortis de l'hôpital comme complètement rétablis. Un patient avait un besoin accru en oxygène et a été temporairement transféré à l'USI pour l'intubation, mais au cours des jours suivants, il s'est rétabli et a été libéré de l'USI.
Suite à ces premiers résultats, un essai clinique multinational, randomisé, contrôlé, initié par l'investigateur, avec jusqu'à 150 patients avec des infections confirmées au COVID-19, nécessitant une hospitalisation en raison d'importants symptômes liés au COVID-19 est prévu. L'étude sera dirigée par le Dr Michael Osthoff, Hôpital universitaire de Bâle, en Suisse.
Bien qu'il s'agisse d'une petite expérience de traitement non contrôlée, les résultats démontrent l'efficacité potentielle de l'utilisation de RUCONEST® comme approche anti-inflammatoire pour inhiber le complément et les systèmes de contact après une infection par le SRAS-CoV-2.
|
Répondre
|
Entré 1,15.
|
Répondre
|
Entré 1,15.
|
Répondre
|
PAS POUR LA LIBÉRATION, LA PUBLICATION OU LA DISTRIBUTION AUX ÉTATS-UNIS OU AU JAPON, EN AUSTRALIE, EN AFRIQUE DU SUD OU DANS TOUTE AUTRE JURIDICTION DANS LAQUELLE DES OFFRES OU DES VENTES DE TITRES SERONT INTERDITES PAR LA LOI APPLICABLE
Pharming annonce le lancement d'une offre d'environ 125 €
millions d'obligations convertibles de premier rang non garanties échéant en 2025
Points forts
Remplace et rembourse la facilité de prêt avec Orbimed
Accélère l'expansion de la production et des capacités commerciales, y compris les nouveaux territoires rachetés à Sobi
Permet à Pharming d'étendre son profil de maturité de la dette pendant la période de développement de son pipeline existant
Leiden, Pays-Bas, 14 janvier 2020: Pharming Group N.V. ("Pharming" ou la "Société")
(Euronext Amsterdam: PHARM) annonce aujourd'hui le lancement d'une offre (l '"Offre") d'environ 125 millions d'euros d'obligations convertibles de premier rang non garanties échéant en 2025 (les "Obligations"). Le produit net de l'émission des Obligations sera utilisé pour rembourser intégralement le prêt d'environ 56 millions de dollars US avec Orbimed Advisors, réduisant ainsi les coûts de financement de la Société et allongeant la maturité de sa dette pendant la période jusqu'à l'approbation de la plupart des pipelines existants de la Société. . Le solde du produit net sera utilisé pour soutenir les dépenses en capital liées à l'expansion de l'infrastructure de commercialisation et de fabrication de la Société, et servira de financement pour le lancement du produit Leniolisib récemment acquis par Pharming et pour d'autres acquisitions / opportunités de licence.
Message complété le 14/01/2020 11:00:35 par son auteur.
Plus de détails sur l'offre
Les Obligations auront chacune un montant en principal de 100 000 €. Les Obligations seront émises au pair et devraient être assorties d'un coupon compris entre 2,25% et 3,00% par an, payable semestriellement à terme échu en versements égaux. À moins d'avoir été convertis, remboursés ou achetés et annulés, les Obligations seront remboursées au pair à la date d'échéance indiquée, qui devrait être le 21 janvier 2025.
Les Obligations seront convertibles en actions ordinaires de la Société (les "Actions"), le prix de conversion initial devant être fixé à une prime comprise entre 35% et 40% au-dessus du prix moyen pondéré en volume (VWAP) d'une Action sur Euronext. Amsterdam entre l'ouverture des négociations à la date de lancement et le prix de l'Offre. Le prix de conversion initial des Obligations sera soumis aux dispositions d'ajustement habituelles qui seront définies dans les termes et conditions des Obligations.
Le nombre d'Actions initialement sous-jacentes aux Obligations devrait être au maximum de 62 433 000, représentant environ 9,9% du capital social actuellement émis de la Société. Tout ajustement du prix de conversion entraînant une augmentation du nombre d’actions de conversion peut nécessiter la Société
Message complété le 14/01/2020 11:04:24 par son auteur.
d'obtenir une nouvelle autorisation de ses actionnaires pour émettre des Actions, accorder des droits de souscription d'Actions et exclure des droits de préemption.
L'Emetteur aura la possibilité de rembourser la totalité, mais pas seulement, des Obligations en circulation au comptant majorées des intérêts courus à tout moment, a) si, le 13 février 2023 ou après cette date, la valeur de parité sur chacune des 20 transactions au moins jours au cours d'une période de 30 jours de négociation consécutifs doivent avoir dépassé 130% du montant principal ou b) si, à tout moment, 85% ou plus du montant total du capital des Obligations initialement émises ont déjà été convertis et / ou rachetés et annulé.
Les conditions définitives des Obligations devraient être annoncées plus tard dans la journée. La clôture et le règlement de l'Offre devraient avoir lieu le ou vers le 21 janvier 2020 (la «Date d'émission»).
Une demande sera faite pour que les Obligations soient admises à la négociation sur l'Open Market (Freiverkehr) de la Bourse de Francfort au plus tard 30 jours après la Date d'Emission.
Dans le cadre de l'Offre, la Société et ses filiales conviendront d'un engagement de blocage concernant de nouvelles émissions d'Actions et de droits d'acquérir des Actions pour une période commençant au prix et se terminant 90 jours civils après la Date d'émission, sous réserve à certaines exceptions habituelles (y compris les exceptions pour les régimes existants d’actionnariat des employés) et la renonciation par le coordinateur mondial unique et le teneur de livre unique.
J.P.Morgan agit en qualité de coordinateur mondial unique et de teneur de livre unique pour l'offre.
Les Obligations seront proposées via un processus accéléré de constitution de livres via un placement privé uniquement à des investisseurs institutionnels en dehors des États-Unis d'Amérique, de l'Australie, de l'Afrique du Sud et du Japon.
|
Répondre
|
.
|
Répondre
|
 0
0
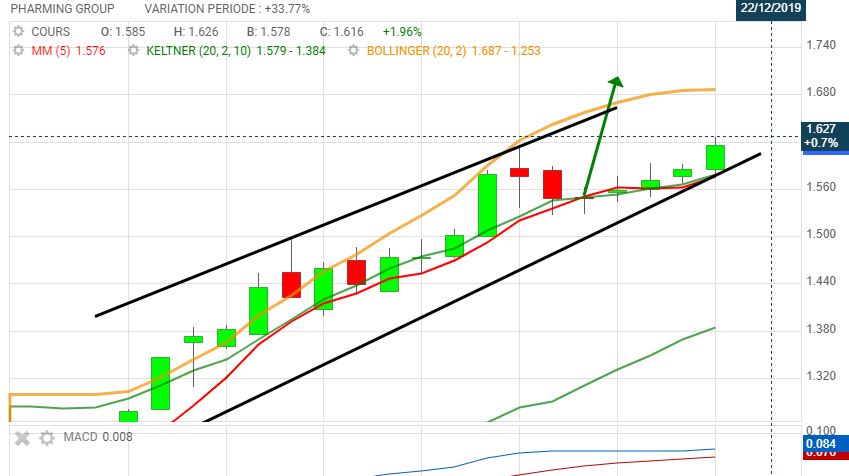
et, elle peut monter jusqu'où ?
Cours temps réel: 1,589€ 0,22%
Message complété le 19/12/2019 10:32:29 par son auteur.
le 10/12 : - Portzamparc passe à l'achat sur Pharming Group en visant un cours de 1,86 euro.
peut elle faire mieux ?
|
Répondre
|
.
|
Répondre
|
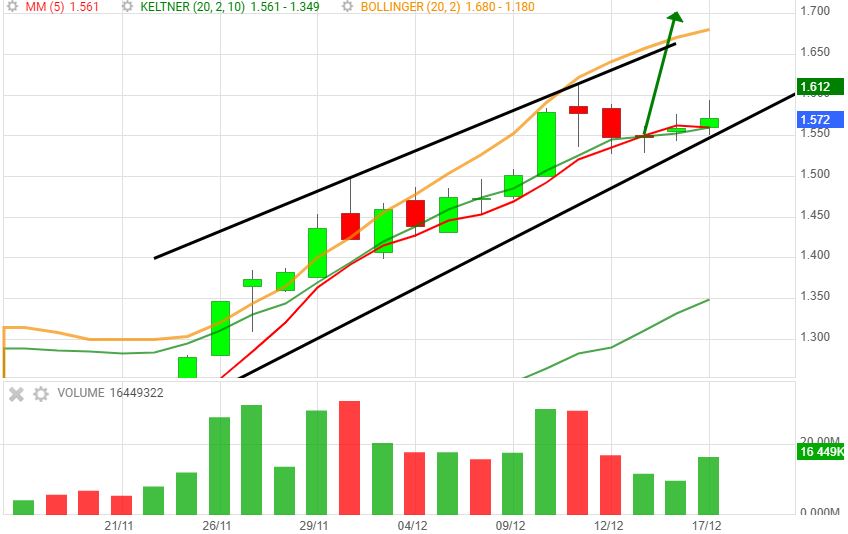
Pharming Group est une biotech hollandaise avec le vent en poupe, en particulier depuis que le géant américain Salix s'occupe de la commercialisation du Ruconest — son traitement phare — outre-Atlantique.
Spécialiste des pathologies rares — le segment le plus risqué de l'industrie pharmaceutique, mais aussi le plus rentable lorsque les choses tournent bien — Pharming développe depuis plus de trente ans une protéine recombinante utilisée dans le traitement de l’angio-œdème héréditaire.
Long, coûteux, ingrat et semé d'embûches, ce processus de recherche et développement en valait cependant la peine.
Les 1,70/1,80 sont à portée.
|
Répondre
|
.
|
Répondre
|
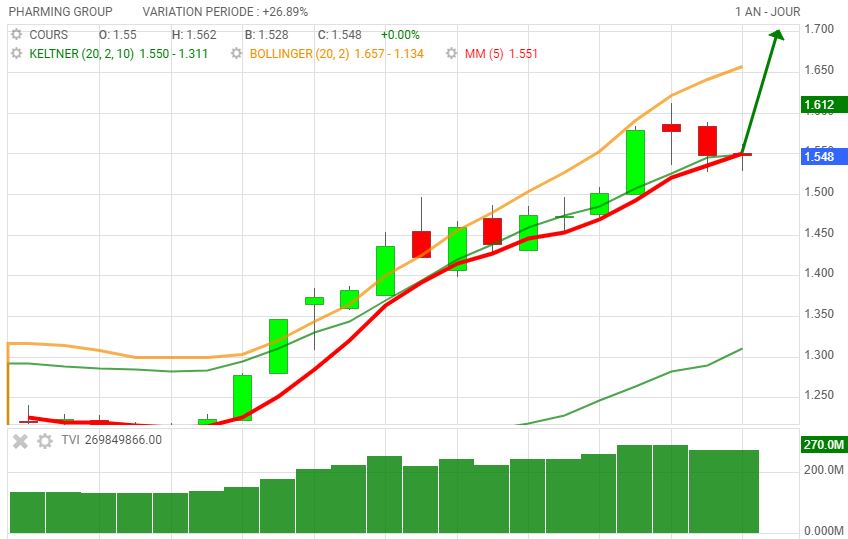
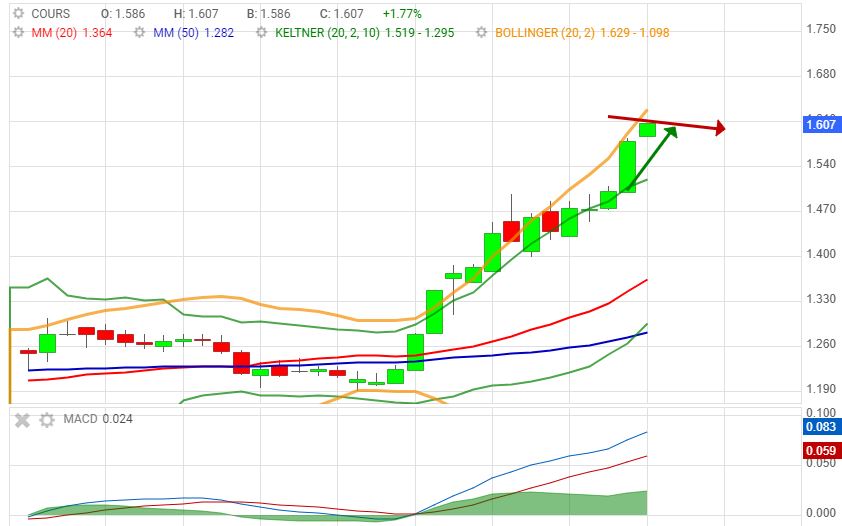
Si volume hausse objectif 1,60/1,65. VAD 4,15%, RSI 70.
|
Répondre
|
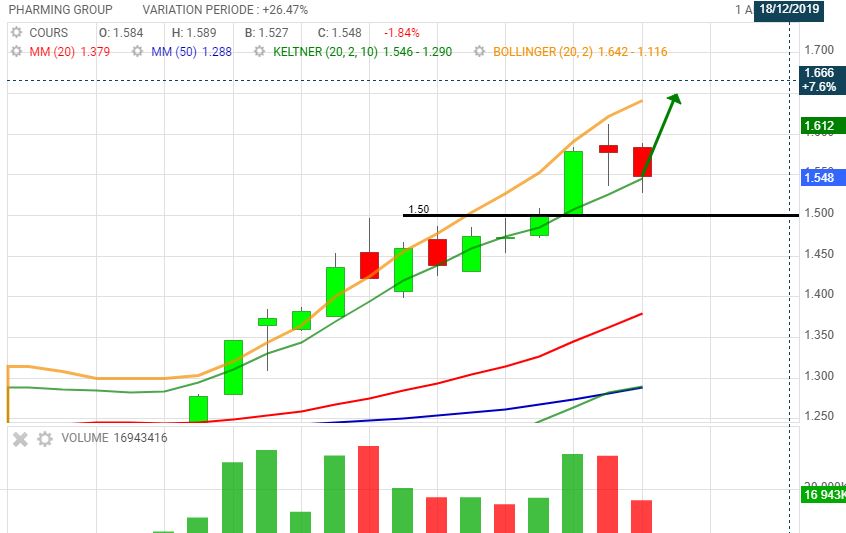
Une pause avant les plus hauts historiques.
|
Répondre
|
Forum de discussion Pharming Group
202011261407 668801 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !