MedinCell : Publication du rapport d’activité et des éléments financiers du premier semestre 2018 (avril-sept. 2018)
Actualité publiée le 03/12/18 18:20
| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
Regulatory News:
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20181203005775/fr/
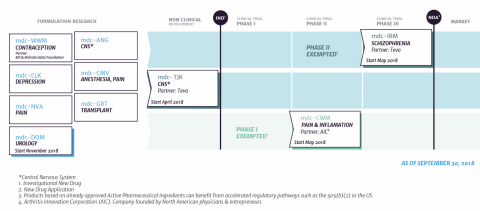
Status of the product portfolio (Photo: MedinCell)
MedinCell (Paris:MEDCL):
Faits marquants du semestre
Aux États-Unis, notre partenaire Teva Pharmaceuticals a lancé une étude clinique* de Phase III* portant sur un traitement expérimental à action prolongée contre la schizophrénie. Il s’agit de la dernière étape du développement clinique avant la demande d’autorisation de mise sur le marché. La formulation de ce produit, mdc-IRM, est basée sur notre technologie brevetée.
Autres produits en développement
- Entrée en développement non-clinique* d’un deuxième produit dans le domaine du Système Nerveux Central (SNC), en partenariat avec Teva
- Démarrage aux États-Unis du premier essai clinique (Phase II*) d’un produit destiné au traitement de la douleur orthopédique post-opératoire en partenariat avec AIC
Visibilité financière accrue
- Trésorerie disponible 11,4 M€ + 4,6 M€ d’actifs financiers non risqués
- Prêt de la BEI : encaissement de 7,5 M€ (12,5 M€ supplémentaires disponibles)
- Introduction en bourse : 31,4 M€ d’augmentation de capital (Événement post-clôture)
- Croissance des dépenses R&D : +23% (par rapport au premier semestre 2017)
Le présent communiqué couvre principalement les éléments que la Société estime essentiels à l’évaluation de son activité, notamment l’état d’avancement de son portefeuille de produits et sa visibilité financière (trésorerie). Le rapport financier semestriel complet de la Société est disponible sur le site internet de MedinCell, dans la rubrique investisseurs (invest.medincell.com), ainsi que sur le site de l’Autorité des Marchés Financiers (AMF).
Les mots suivis d’un * sont définis dans le lexique à la fin de ce communiqué de presse
Première Phase III* aux États-Unis (programme mdc-IRM)
Le programme le plus avancé utilisant notre technologie est désormais en étude clinique de Phase III aux États-Unis. C’est la dernière étape avant la demande d’autorisation de mise sur le marché. Utilisant la rispéridone, un principe actif déjà largement adopté, mdc-IRM est le premier produit d’une nouvelle génération d’injectables à action prolongée pour le traitement d’entretien de la schizophrénie développés en partenariat avec Teva. Le groupe pharmaceutique pilote et finance le développement du produit dont il assurera la commercialisation s’il est approuvé. MedinCell reçoit des paiements échelonnés à des étapes précises du développement et de la commercialisation et percevra des royalties sur les ventes.
L’étude actuelle porte sur des paramètres tels que la facilité d'utilisation et l'injection sous-cutanée, afin de déterminer si elle répond aux besoins médicaux non satisfaits en matière de traitement de la schizophrénie. En 2017, les antipsychotiques sous forme injectable à action prolongée représentaient un marché de 4,7 milliards de dollars dans les pays développés, en croissance annuelle moyenne de 21% sur les dernières années.
Ce produit illustre le profil bénéfice/risque particulièrement attractif des programmes de MedinCell, basés sur des molécules dont l’efficacité est prouvée. Il bénéficie ainsi aux États-Unis de la procédure réglementaire allégée 505(b)(2) qui l’a notamment dispensé de Phase II.
L’étude de Phase III démarrée en mai 2018 porte sur 596 patients répartis dans 80 centres.La fin estimée de collecte des données est prévue en janvier 2020.
Avancement du portefeuille de produits
Les résultats positifs des premiers essais cliniques ayant marqué une étape majeure dans la validation de la technologie BEPO®, la Société met désormais en œuvre sa stratégie d’élargissement de son portefeuille de produits afin d’accélérer son impact sur la santé dans le monde et la création de valeur.
Programmes en développement
Au cours du premier semestre de l’exercice 2018, les étapes suivantes ont été atteintes :
- Entrée en développement non-clinique d’un deuxième produit dans le
domaine du Système Nerveux Central (SNC), en partenariat avec Teva
Ce programme pourrait faire l’objet d’une demande d’autorisation d’essai clinique* et entrer en développement clinique au cours du premier semestre 2019.
- Démarrage aux États-Unis de l’étude clinique de Phase II du produit
mdc-CWM pour le traitement de la douleur et de l’inflammation
post-opératoire en chirurgie orthopédique, en partenariat avec la
société canadienne Arthritis Innovation Corporation (AIC)
Les résultats de cette étude sont attendus en 2019.
Programmes en recherche de formulation*. Cette première phase vise à obtenir un prototype du produit justifiant le passage du programme en développement non-clinique lorsque les chances de succès sont estimées favorables.
- Démarrage du programme mdc-DOM (urologie)
-
Poursuite des six programmes déjà en cours de recherche de
formulation, dans différentes aires thérapeutiques : psychiatrie,
transplantation, douleur chronique, anesthésie et santé féminine
(formulation d’un contraceptif injectable actif pendant 6 mois en
collaboration avec la Fondation Bill & Melinda Gates)
Certains de ces programmes pourraient entrer en développement non-clinique au cours du premier semestre 2019.
Recrutement de Joël Richard à la tête des opérations techniques et pharmaceutiques. Il est en charge des activités de recherche de formulation, de développement non-clinique et de définition de la stratégie réglementaire* propre à chaque produit. Son arrivée s’inscrit dans la stratégie de renforcement des compétences internes. Joël Richard rejoint MedinCell fort de nombreuses années d’expérience à des postes de management de R&D chez Merck Serono, Etypharm et plus récemment Ipsen, où il supervisait les activités de développement pharmaceutique.
Information financière sélectionnée du premier semestre 2018
Renforcement de la trésorerie disponible et de la visibilité financière
Au 30 septembre 2018, MedinCell disposait d’une trésorerie de 11,4 M€ en fonds disponibles et 4,6 M€ d’actifs financiers non risqués (contre respectivement 8,8 M€ 4,7 M€ il y a un an). Le premier semestre 2018 a été marqué par le succès de la stratégie de financement de la Société visant à lui donner les moyens et la visibilité financière nécessaires à l’accélération du développement de son portefeuille de produits. La Société a notamment réalisé les opérations financières suivantes :
- Émissions d’Obligations Remboursables en Actions (ORA)* souscrites par CM-CIC Innovation et BNP Paribas Développement pour un montant de 3,2 M€. Ces émissions s’ajoutent à celles réalisées au cours du semestre précédent et souscrites par certains fonds gérés par Seventure Partners (groupe BPCE - Natixis) pour un montant de 4 M€.
- Signature d’un prêt de 20M€ de la Banque Européenne d’Investissement (BEI) pourfinancer les phases de recherche de formulation et de développement de produits propres de la Société. Un premier encaissement de 7,5 M€ a eu lieu en juin 2018. Le versement des deux autres tranches est soumis à des objectifs. Certains ayant déjà été atteints, la Société peut à tout moment demander à la BEI le versement de la seconde tranche d’un montant de 7,5 M€.
- Événement post-clôture - Introduction en bourse sur Euronext Paris à hauteur de 31,4 M€ brut après exercice de l’option de surallocation. L’opération a notamment été réalisée avec le soutien des investisseurs financiers de la Société (CM-CIC Innovation, Seventure Partners, BNP Paribas Développement), de Teva (à hauteur de 6 M€ en compensation de créance) et de fonds français et internationaux, spécialistes de la santé ou de l’investissement socialement responsable.
Compte tenu de cette trésorerie disponible, à mettre en parallèle avec ses niveaux actuels et prévisibles de consommation de cash (flux de trésorerie d’exploitation négatif de 6,4 M€ sur le premier semestre 2018), la Société bénéficie d’une solide visibilité financière. Elle devrait de plus continuer à bénéficier de revenus de partenariats (revenus de services et paiements d’étape) et du Crédit Impôt Recherche.
| (en milliers d'¤) |
30/09/2018 6 mois |
30/09/2017 6 mois | |||
| Flux net de trésorerie généré par l'activité | (6 371) | (4 740) | |||
| Flux net de trésorerie lie aux opérations d'investissement | (404) | 1 933 | |||
| Flux net de trésorerie lie aux opérations de financement | 9 352 | 3 269 | |||
| Variation de la trésorerie nette | 2 577 | 462 | |||
| Trésorerie et équivalents de trésorerie à l'ouverture | 8 791 | 3 824 | |||
| Trésorerie et équivalents de trésorerie à la clôture | 11 368 | 4 286 | |||
Tableau des flux de trésorerie consolidé | |||||
Compte de résultat
A- Produit des activités ordinaires : 1,8 M€
Chiffre d’Affaires
Les revenus du premier semestre de l’exercice 2018 sont essentiellement issus de prestations de service pour les activités de recherche de formulation des produits supportés par des partenaires. La baisse de revenus par rapport au premier semestre de l’année précédente reflète paradoxalement l’avancement des projets en partenariat avec Teva. Le groupe pharmaceutique prend en effet directement à sa charge les activités de développement pré-cliniques et cliniques une fois l’étape de recherche de formulation achevée, diminuant de fait la rémunération de MedinCell.
Ce repli a été partiellement compensé par les revenus tirés de la collaboration avec la Fondation Bill & Melinda Gates pour le développement d’un contraceptif injectable actif pendant 6 mois.
Il n’y a par ailleurs pas eu de revenus liés au franchissement de nouvelles étapes pour les programmes en partenariat. Les paiements relatifs à l’avancée des programmes mdc-IRM et mdc-TJK, passés respectivement en Phase III et en développement préclinique, avaient eu lieu au semestre précédent.
La Société rappelle que les premiers revenus liés aux ventes de produits devraient être les royalties issues de la commercialisation des produits développés avec Teva. D’ici-là, en raison du cycle de développement des produits et en fonction des paramètres financiers mis en place dans le cadre de partenariats (ceux-ci pouvant intégrer ou non certains éléments tels que la facturation de services de formulation, des paiements d'étapes, des royalties, le partage de coûts, le partage de profits, etc.), son chiffre d’affaires pourra varier significativement d’une année sur l’autre.
Autres produits des activités ordinaires
La Société, au titre de ses activités de recherche et de développement bénéficie du Crédit d’Impôt Recherche (CIR). Traduisant la croissance des dépenses en R&D, celui-ci a augmenté de 19% comparé à la même période de l’année précédente pour s’établir à 1 M€. La Société anticipe son encaissement au second semestre 2019.
B- Dépenses opérationnelles : 8,4 M€
Les dépenses opérationnelles ont augmenté de 24% par rapport à la même période de l’année précédente. Plus de la moitié des dépenses additionnelles concernaient la R&D dont le budget a augmenté de 23% ce semestre. En phase avec la stratégie d’élargissement du portefeuille de produits de la Société, ces investissements en R&D ont ainsi permis de :
- Renforcer les équipes scientifiques, passées de 68 à 84 personnes sur un an, notamment celle dédiée à évaluer et valider la compatibilité des molécules entrant dans la composition des produits pressentis pour passer en phase de recherche de formulation. Cette étape initiale vise à augmenter les chances de succès propres à chaque programme
- Financer les services CRO* partenaires de MedinCell afin de faire avancer les programmes en cours de recherche de formulation
Les frais marketing et commerciaux ont quant à eux augmenter de 33% par rapport à la même période de l’année précédente avec notamment un renforcement important de l’équipe de marketing stratégique et de market access dont le rôle est d’identifier les futurs traitements à libération contrôlée qui seront développés par la Société et d’en évaluer leurs potentiels commerciaux.
Pour soutenir les opérations, les frais généraux ont augmenté de 20%. A noter, qu’une partie de cette augmentation a été consacrée à la formation des équipes, nécessaire pour accompagner la stratégie de développement de la Société. Une autre partie importante est imputable aux opérations de financement menées au cours du semestre, et notamment aux déplacements qu’elles ont nécessités.
C- Charges financières : 3,3 M€
L’introduction en bourse a généré des charges exceptionnelles de financement à hauteur de 2,3 M€. Ce montant inclut l’actualisation à la juste valeur des ORA aux normes IFRS* (sans effet sur la trésorerie disponible) ainsi que l’anticipation du remboursement partiel de la dette de Teva, généré par sa participation à l’introduction en bourse sous forme de compensation de créance.
| (en milliers d'¤) |
30/09/2018 6 mois |
30/09/2017 6 mois | |||||||||||||
| Vente des Produits, Royalties | - | - | |||||||||||||
| Produits perçus au titre des prestations de développement | 716 | 1 808 | |||||||||||||
| Licences, Milestones | - | - | |||||||||||||
| Produits liés à la vente de polymères | 66 | 45 | |||||||||||||
| Chiffre d'Affaires | 783 | 1 853 | |||||||||||||
| Autres produits des activités ordinaires | 1 018 | 855 | |||||||||||||
| A | Produits des activités ordinaires | 1 801 | 2 708 | ||||||||||||
| Coût des produits et services vendus | (78) | (33) | |||||||||||||
| Frais de recherche et développement (b) | (4 797) | (3 895) | |||||||||||||
| Frais marketing et commerciaux | (1 171) | (883) | |||||||||||||
| Frais généraux et administratifs (c) | (2 372) | (1 977) | |||||||||||||
| B | Total Dépenses opérationnelles | (8 418) | (6 787) | ||||||||||||
| Résultat opérationnel Courant | (6 617) | (4 080) | |||||||||||||
| Autres charges/ produits opérationnels | (20) | (29) | |||||||||||||
| Résultat opérationnel | (6 637) | (4 109) | |||||||||||||
| Produits / (charges) de l'endettement financier brut | (981) | (891) | |||||||||||||
| Autres produits / (charges) financières | (2 246) | 177 | |||||||||||||
| C | Résultat financier (d) | (3 227) | (714) | ||||||||||||
| Résultat avant impôts | (9 864) | (4 823) | |||||||||||||
| (Charge) Produit d'impôt | 34 | (40) | |||||||||||||
| Résultat Net | (9 830) | (4 863) | |||||||||||||
| Attribuable aux actionnaires de MedinCell | (9 830) | (4 863) | |||||||||||||
| Attribuable aux participations ne donnant pas le contrôle | - | - | |||||||||||||
| Résultat par action en ¤ | (0,68) | (0,34) | |||||||||||||
| Résultat dilué par action en ¤ | (0,68) | (0,34) | |||||||||||||
Compte de résultat consolidé | |||||||||||||||
A propos de MedinCell
MedinCell est une société pharmaceutique technologique qui développe un portefeuille de produits injectables à action prolongée dans différentes aires thérapeutiques en associant sa technologie propriétaire BEPO® à des principes actifs déjà connus et commercialisés. MedinCell, à travers la libération contrôlée et prolongée du principe actif, rend les traitements médicaux plus efficients grâce notamment à l’amélioration de l’observance, c’est-à-dire le respect des prescriptions médicales, et à la diminution significative de la quantité de médicament nécessaire dans le cadre d’un traitement ponctuel ou chronique. La technologie BEPO® permet de contrôler et de garantir la délivrance régulière à dose thérapeutique optimale d’un médicament pendant plusieurs jours, semaines ou mois à partir de l’injection sous-cutanée ou locale d’un simple dépôt de quelques millimètres, entièrement biorésorbable. Basée à Montpellier, MedinCell compte actuellement plus de 120 collaborateurs de plus de 25 nationalités différentes.
Lexique
Développement Clinique
Le développement clinique se décompose en 3 grandes phases d’essais menés sur des panels humains :
- La Phase I est menée sur des volontaires sains pour évaluer leur tolérance au traitement.
- La Phase II est menée sur un groupe restreint de patients malades pour évaluer l’efficacité du traitement, la dose optimale de médicament et ses éventuels effets secondaires.
- La Phase III est quant à elle menée sur un groupe large de patients malades pour comparer l’efficacité du traitement à un placebo ou un traitement de référence. En cas de succès, c’est la dernière étape avant la mise sur le marché du produit.
A noter : les produits développés par MedinCell utilisant des principes actifs déjà largement connus et commercialisés, peuvent être dispensés de certaines études cliniques.
Recherche de formulation
Première étape de développement d’un programme. Elle permet d’obtenir un prototype du produit respectant les spécifications ciblées, notamment la durée d’action et la dose de principe actif qui doit être diffusée de manière régulière. Pour chaque produit, une nouvelle association de polymères est créée, ce qui rend chaque formulation unique et exclusive.
Développement non-clinique
Lancé après la mise au point du prototype, le développement non-clinique regroupe une série d’études et d’opérations visant à confirmer la viabilité du produit, à tester sa sécurité ainsi qu’à établir les bases scientifiques et la stratégie réglementaire nécessaires à toutes demandes d’autorisations d’essais cliniques.
Stratégie réglementaire CMC (Chemistry Manufacturing Control)
Elle permet de constituer le dossier pour la demande d’essais cliniques qui regroupe tous les éléments nécessaires prouvant que le produit peut être administré à des patients en toute sécurité et que la société est en mesure de fabriquer le produit à l’échelle pilote.
Demande d’autorisation d’essais cliniques
Le lancement d’essais sur l’homme est soumis à une autorisation préalable des autorités en charge de la santé comme la FDA (Federal Drug Administration) aux États-Unis et l’AEM (Agence Européenne des Médicaments) en Europe. La demande d’autorisation d’essais cliniques repose sur un dossier constitué à partir des travaux menés au cours du développement non-clinique.
CRO (Contract Research Organization)
Une CRO est une entreprise qui fournit des services dans le domaine de la recherche biomédicale pour l'industrie pharmaceutique ou biotechnologique. L'intervention des CROs peut se retrouver à toutes les phases de la recherche et développement depuis les études précliniques, jusqu'à la commercialisation et la pharmacovigilance en passant par la conduite d'essais cliniques ou l'assistance dans la conduite de travaux de recherche.
ORA
Une ORA (Obligation Remboursable en Action) est une obligation, c’est-à-dire une part d’un emprunt émis par une société, présentant la particularité d'être remboursable en action.
IFRS
Ce sont les normes internationales d'information financière élaborées par le Bureau des standards comptables internationaux imposées aux entreprises cotées ou faisant appel à des investisseurs pour harmoniser la présentation de leurs états financiers.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20181203005775/fr/
© Business Wire
Vous avez aimé cet article ? Partagez-le avec vos amis avec les boutons ci-dessous.




Soyez le premier à réagir à cet article
Pour poster un commentaire, merci de vous identifier.
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !