Novacyt: le test du coronavirus peut être commandé - Page 13
Cours temps réel: 0,48 2,13%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
Coronavirus: la "souveraineté" industrielle française, un cap parfois lointain
|
Répondre
|
Novacyt annonce :
• Le CNR de l'Institut Pasteur donne son approbation pour la France
• Approbation du Ministère de la santé en Thaïlande
Communiqué de presse [PDF] : Le 6 Avril 2020
https://www.businesswire.com/news/home/20200405005032/fr/
Regulatory News:
Novacyt (ALTERNEXT : ALNOV ; AIM : NCYT), spécialiste mondial du diagnostic clinique, annonce que le Centre National de Référence des Virus des Infections Respiratoires (dont la grippe) de l'Institut Pasteur, le centre de recherche biomédicale de renommée internationale ayant pour objectif d'améliorer la santé publique en France, a approuvé le test COVID-19 développé par Primerdesign, la division de diagnostic moléculaire du Groupe. Le test marqué CE est disponible pour une distribution immédiate sur le marché français.
Le 2 avril 2020, Novacyt a également reçu l'approbation de son test COVID-19 par le Ministère de la santé de Thaïlande.
Graham Mullis, Directeur général de Novacyt, commente :
« En tant qu'entreprise franco-britannique, je suis ravi que Novacyt soit en mesure de soutenir ses deux marchés nationaux dans la lutte contre cette pandémie. L'évaluation et l'approbation par l'Institut Pasteur de notre test COVID-19 est une validation importante et je suis reconnaissant à Atothis, notre partenaire de distribution en France, pour ses efforts de collaboration avec l’institution. Je me réjouis de pouvoir aider les authorités françaises à satisfaire ses exigences de test du COVID-19. »
Le test COVID-19 de Primerdesign a été accrédité par un certain nombre d'autorités réglementaires mondiales de premier plan, dont Public Health England et la Food and Drug Administration américaine. Outre le test actuellement approuvé au Royaume-Uni, aux États-Unis, en France, en Inde, aux Philippines, en Argentine et en Thaïlande, il est disponible sur les marchés qui acceptent directement l'accréditation du marquage CE sans qu'il soit nécessaire d'obtenir d’autre approbation.
Cette annonce contient des informations privilégiées aux fins de l’Article 7 du règlement (UE) 596/2014
A propos de Novacyt Group
Le Groupe Novacyt est une entreprise internationale de diagnostic qui génère un portefeuille croissant de tests de diagnostic in vitro et moléculaire. Ses principales forces résident dans le développement de produits de diagnostic, la commercialisation, la conception de contrats et la fabrication. Les principales unités commerciales de la Société comprennent Primerdesign et Lab21 Products, qui fournissent une vaste gamme d'essais et de réactifs de haute qualité dans le monde entier. Le Groupe sert directement les marchés de l'oncologie, de la microbiologie, de l'hématologie et de la sérologie ainsi que ses partenaires mondiaux, dont les grandes entreprises.
Pour plus d'informations, veuillez consulter le site Internet : www.novacyt.com
À propos du COVID-19
Les chercheurs du Centre chinois de contrôle et de prévention des maladies et leurs collaborateurs ont séquencé le nouveau coronavirus pathogène 2019 (COVID-19) à partir d'échantillons de patients et ont constaté qu'il était génétiquement distinct du virus du syndrome respiratoire aigu sévère (SRAS) qui a causé une épidémie en 2002 et 2003, ainsi que du virus du syndrome respiratoire du Moyen-Orient (MERS) qui a été détecté en 2012.
|
Répondre
|
Humour pour gars d'ain
Par rapport à sa phrase :
Pas mauvais ce graphe, quand même !
Et bien moi je te dis comme m'avait fait la remarque de mon prof de dessin industriel ( Mr .......votre dessin sait juste une forêt de traits )
Je vous mets 8 pour le soin apporté au tracé ,mais 2 pour le plan .
Mon humble avis
bonne fin de journée
Un test viens va être commercialisé en Italie ( j'espère qu'il ne feras pas trop d'ombres à NOVACYT
|
Répondre
|
Novacyt peu atteindre les 2,40 rapidement,on Véra lundi.
bon week-end
|
Répondre
|
Lundi
|
Répondre
|
Il manque la date à laquelle on atteindra 2,49€
Oui, je sais ..... lol
|
Répondre
|
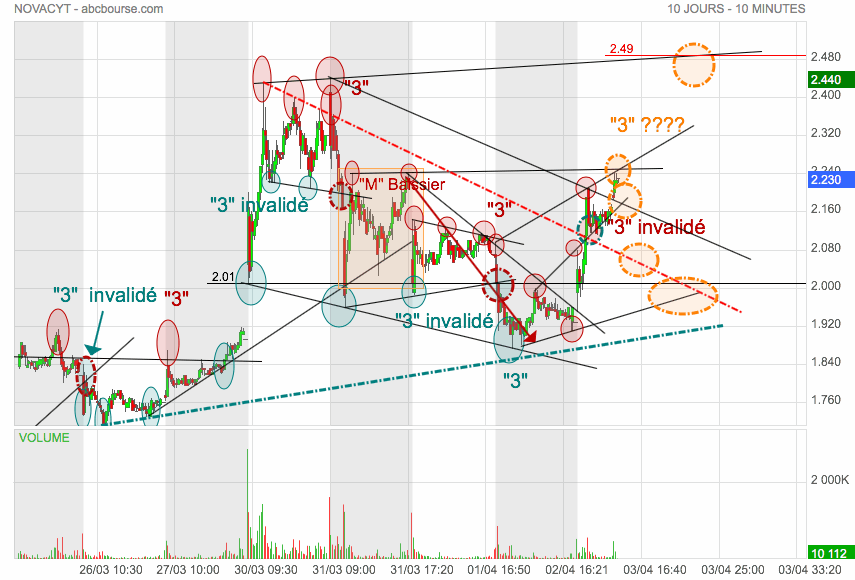
Pas mauvais ce graphe, quand même !
tout y est ! A comparer avec celui du dessous...
.
|
Répondre
|
Bonjour gars d'ain
Certains ont vendu dans la panique ( les loups étaient là)
Est ce une bulle ( je suppose que oui ) par contre pour le long terme pour ceux qui se sont placés en bas 1.98 / 20 euros
Ils devraient plutôt bien être bénéficiaire ( je suppose qu'il y a des contrats qui ont été signé dans la hâte )
J'avais posté ça ( Analyses et conseils )
Novacyt a désormais dépassé le cap des 20 M€ de commandes pour son test Covid-19, désormais validé dans de nouveaux pays, l'Inde et l'Argentine. La société cherche à accroître ses capacités de production.
Je pense et j'espère que notre gouvernement à retenu la leçon .
Donc un titre à suivre long terme .2.84 euros
@ plus un très .........................humble avis
|
Répondre
|
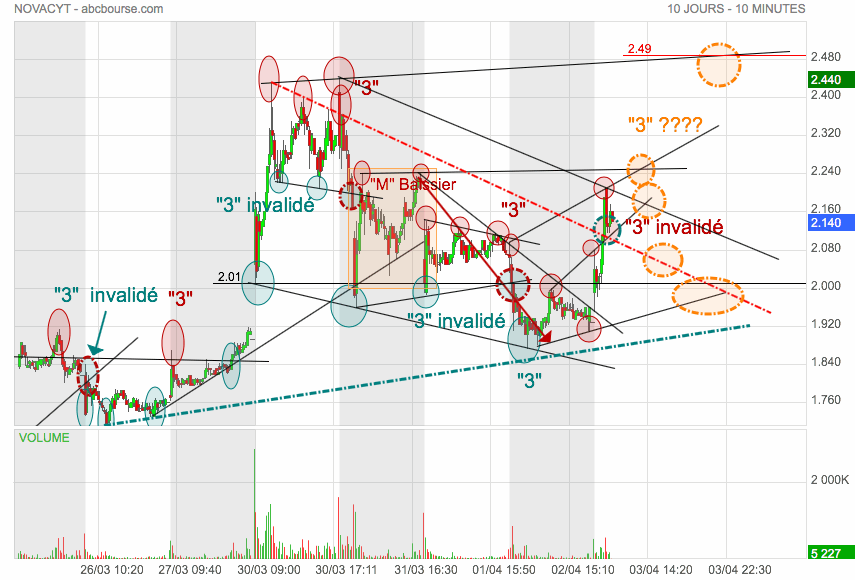
Le terrain reste "miné" pour la journée ...
Regarder les ronds "Orange" qui sont les possibilités de "3" creux ou top ...
.
|
Répondre
|
Point important sur les études
Tableau d'information du COLLEGE MEDECINE GENERAL
Covid-19 et hydroxychloroquine: connaître les enjeux pour informer les patients
https://lecmg.fr/wp-content/uploads/2020/03/InfogChloroquine-1.pdf
Merci à MCFIVE
|
Répondre
|
Pas tant de fleurs, ça gèle encore ...
J'essaie juste de mettre ce que je vois et ça arrive aussi que je plante de temps en temps
(Normal, pour un jardinier !...)
|
Répondre
|
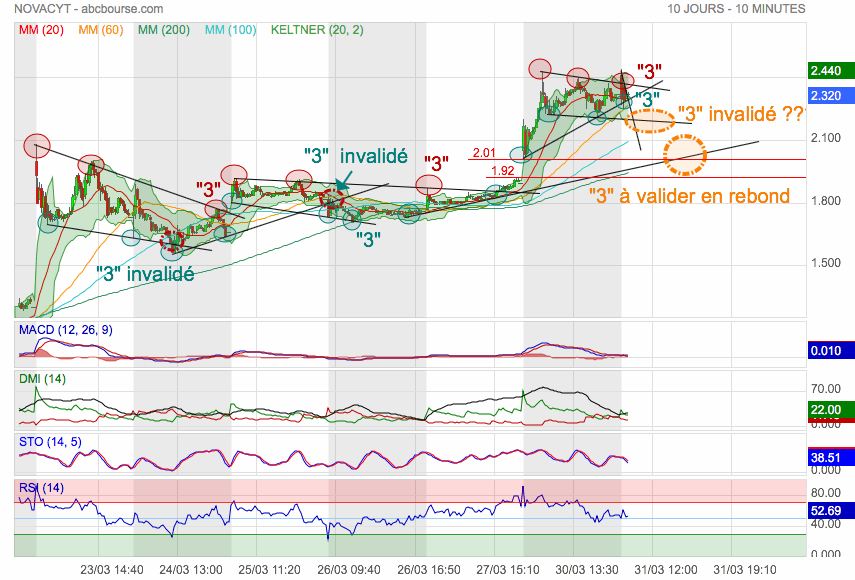
Un beau graphe en tendance intraday : selon moi, on consolide avant repli...
On voit que l'on a 2 triples creux à terminer en figure (2 Cercles pointillés Oranges) :
• Il est probable qu'on invalide le premier pour aller chercher le second en rebond.
• Le second doit être validé sous peine sinon de reboucher le GAP haussier sous 2,01.
.
|
Répondre
|
merci pour ces infos
|
Répondre
|
philiberts,
Un peu de logique !
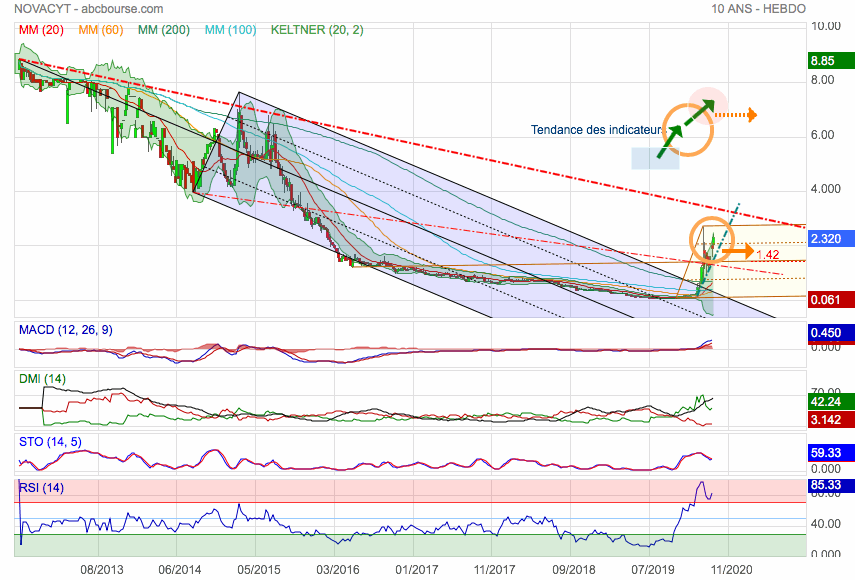
C'est pourtant simple : on voit sur ce graphe qu'on revenu sur le rail baissier qu'on avait quitté en 2015 : autrement-dit, le changement de dimension et d'importante de l'activité est reconnu. il est validé par les cours de bourse. De plus la dernière fourchette en jaune et marron, nous montrons maintenant les niveaux qui sont importants :
• Sortie haute de Fourchette
• Retour possible en test médiane vers 1,42 euros...
Tu vois ça sert à quelque chose ...
Message complété le 31/03/2020 09:05:05 par son auteur.
Il est encore intéressant de voir que l'oblique baissière arrivera au niveau de la dent de fourchette haute vers fin 2022 / 23 et qu'on pourrait donc sortir définitivement du biais baissier qui pèse sur l'action depuis sont introduction.
Message complété le 31/03/2020 09:14:21 par son auteur.
Raz le bol du T9 : il m'a réintroduit plein de saloperies dans le texte....
|
Répondre
|
 0
0
Ouverture à +5%
|
Répondre
|
Bonjour a tous
A gars d'ain
La je ne comprend pas pourquoi utiliser un graph sur 5 ans en hebdo ? c est sure que le RSI est en surchauffe.
Novacyt y a 5 ans personne la connaissait.
Si je prend un graphique sur 1 ans ou 6 mois en journalier le RSI n est pas en surchauffe ne serait pas plus judicieux de se baser sur une période plus courte ? pour Novacyt
Message complété le 31/03/2020 07:11:19 par son auteur.
|
Répondre
|
L'intérêt pour le titre avec son développement réussi de TEST COVID 19 n'est prêt de se démentir.
La tendance est en surchauffe totale. La boite croûle sous le commandes et commercialise dans ... 80 pays. Alors qu'il y'a encore 6 mois, elle était quasi on fond du trou...
Elle vient de signer un partenariat important la semaine dernière pour soutenir son développement et devrait accélérer encore prochainement, vu qu'on envisage dans certains pays un dépistage systématique de la population afin de savoir qui l'a eu et qui serait protégé par une immunité acquise...
Les indicateurs sont en surchauffe totale et ont même pris feu avec les volumes du RSI...
.
|
Répondre
|
Novacyt :
• Point sur les ventes et la production
• Le test COVID-19 approuvé en Inde et en Argentine
Communiqué de PRESSE [PDF] • March 30, 2020 02:00 AM Eastern Daylight Time
https://www.businesswire.com/news/home/20200329005035/fr/
------------------------------------------------------------------------------------------------------------------------------
PARIS & CAMBERLEY, Angleterre--(BUSINESS WIRE)--Regulatory News:
Novacyt (ALTERNEXT : ALNOV ; AIM : NCYT), spécialiste mondial du diagnostic clinique, a le plaisir de faire le point sur le nouveau test de détection du coronavirus (COVID-19) mis au point par Primerdesign, la division de diagnostic moléculaire du Groupe basée au Royaume-Uni.
Ventes et réglementation
En date du 27 mars 2020, Primerdesign a vendu et reçu des commandes pour plus de 17,8 millions de livres sterling (19.6 millions d'euros) de ses tests COVID-19, marqués CE et destinés à la recherche (RUO). La demande pour ce test continue d'augmenter et le 27 mars, Primerdesign a reçu sa commande la plus importante à ce jour de 1,4 million de livres (1,5 million d'euros) d'un nouveau client en Inde, à la suite de l'approbation de l'utilisation d'urgence du test le 26 mars 2020.
Novacyt commercialise désormais son test COVID-19 dans plus de 80 pays et le Moyen-Orient devient la région la plus active avec des commandes d’un montant de 1,6 million de livres (1,8 million d'euros) reçues en moins de deux semaines. Le Groupe prévoit de signer d'autres partenariats de distribution au cours des prochaines semaines dans cette région et espère également pouvoir faire part de ses progrès sur le marché américain suite à l'autorisation d'utilisation d'urgence accordée par la FDA américaine le 23 mars dernier.
Novacyt continue de travailler avec un nombre croissant d'hôpitaux au Royaume-Uni, fournissant désormais plus de 21 hôpitaux à travers le pays. La société indique également que son test COVID-19 est désormais utilisé par le Health Service Executive en Irlande et que des commandes de tests d'un montant de 1,1 million de livres sterling (1,2 million d'euros) ont été reçues.
Bien que Novacyt ne soit pas en mesure de prédire avec certitude le taux de conversion des demandes en cours et donc de fournir des indications précises concernant son chiffre d’affaires, le Management confirme qu’il contribuera de manière significative à l'amélioration de la marge brute et de la rentabilité du Groupe.
Le 27 mars 2020, Novacyt a reçu l'approbation de l'Administration nationale des médicaments, des aliments et des dispositifs médicaux (ANMAT) en Argentine.
Le Groupe poursuit son vaste programme de surveillance de l'évolution de la souche du virus SRAS-CoV-2 et la dernière mise à jour continue de démontrer une homologie à 100 % de son test COVID-19. Cela signifie avoir comparé le test COVID-19 du Groupe à 1 700 variations connues de la séquence du génome du virus COVID-19 d'origine. Le Management estime que cette surveillance accrue et la performance de l’homologie continueront à permettre aux cliniciens d'utiliser le test en toute confiance.
Capacité de production
Suite à l'annonce du 12 mars 2020, Novacyt confirme que BioType Diagnostic GmbH (BioType) est son partenaire de production en Europe continentale. L'entreprise BioType, établie à Dresde en Allemagne, accroît de façon remarquable sa production et les premiers lots ont été livrés au site Primerdesign de Southampton pour assemblage final. Le Management indique également avoir augmenté son contrat de sous-traitance avec BioType qui, combiné à la capacité de Southampton, permettra de produire plus de 4 millions de tests par mois.
Alors que le Groupe attend avec impatience de recevoir de YourGene Health Plc, son partenaire au Royaume-Uni, les premiers lots de produits associés au test COVID-19, Novacyt est également en négociations avancées avec un autre sous-traitant au Royaume-Uni afin d'augmenter encore sa capacité de production.
La société s'est engagée à acheter des matières premières supplémentaires pour produire un total de 18 millions de tests COVID-19 et, la demande augmentant à un rythme de plus en plus rapide, cette question continuera d'être réévaluée au cours des prochaines semaines.
Graham Mullis, Directeur général de Novacyt, commente :
« Nous continuons d’enregistrer une demande sans précédent pour notre test COVID-19, la croissance des commandes dépassant chaque semaine nos attentes. Ainsi, malgré nos efforts pour nous assurer de répondre à la demande, notre capacité à accroître la production aussi rapidement que nous le souhaiterions commence à limiter le taux de croissance du chiffre d’affaires. Ceci reste la priorité immédiate du Groupe et notre objectif est de rendre disponible aussi rapidement que possible un maximum de nos produits pour le plus grand nombre de cliniciens à travers le monde. Nous sommes très heureux de la manière dont BioType et YourGene, nos sous-traitants, soutiennent Novacyt pendant cette période et nous continuons d’évaluer d’autres options pour accroître notre capacité de production afin de répondre à la demande mondiale pour notre test COVID-19. Je tiens à nouveau à remercier tous nos employés et fournisseurs pour leur travail acharné et leur soutien durant cette pandémie. »
Cette annonce contient des informations privilégiées aux fins de l’Article 7 du règlement (UE) 596/2014
A propos de Novacyt Group
Le Groupe Novacyt est une entreprise internationale de diagnostic qui génère un portefeuille croissant de tests de diagnostic in vitro et moléculaire. Ses principales forces résident dans le développement de produits de diagnostic, la commercialisation, la conception de contrats et la fabrication. Les principales unités commerciales de la Société comprennent Primerdesign et Lab21 Products, qui fournissent une vaste gamme d'essais et de réactifs de haute qualité dans le monde entier. Le Groupe sert directement les marchés de l'oncologie, de la microbiologie, de l'hématologie et de la sérologie ainsi que ses partenaires mondiaux, dont les grandes entreprises.
Pour plus d'informations, veuillez consulter le site Internet : www.novacyt.com
À propos du COVID-19
Les chercheurs du Centre chinois de contrôle et de prévention des maladies et leurs collaborateurs ont séquencé le nouveau coronavirus pathogène 2019 (COVID-19) à partir d'échantillons de patients et ont constaté qu'il était génétiquement distinct du virus du syndrome respiratoire aigu sévère (SRAS) qui a causé une épidémie en 2002 et 2003, ainsi que du virus du syndrome respiratoire du Moyen-Orient (MERS) qui a été détecté en 2012.
|
Répondre
|
2.43 2.39 2.36 idem pour moi
Message complété le 30/03/2020 17:13:57 par son auteur.
juste pour moi c est pas une louche!
|
Répondre
|
je viens de revendre la grosse louche 2700 acquise 1,834 euros à 2,33.
C'est toujours ça de pris. Triple top baissier en oblique sur 2,37. Mon ordre à 2,37 est passé. j'ai préféré vendre.
Message complété le 30/03/2020 17:16:07 par son auteur.
T9, tu me les casses menu !
Lire : Mon ordre à 2,37 est PAS passé.
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !