CARMAT - News - Recos - Page 2
Cours temps réel: 0,099 -1,00%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
Pendant le labo casse la tête.
Un centre médical Maryland aux Etats Unis a réalisé avec un coeur de cochon sur le patient.
Succès dingue.
|
Répondre
|
savez vous quand il sera commercialisé ?
|
Répondre
|
Un petit Pb toutefois : j’ai entendu ces derniers jours aux infos RTL qu’un coeur de cochon avait été greffé sur un homme (au dernier stade de vie) . En Angleterre, je crois.
Et le coeur greffé s’est remis à battre. Affaire à suivre, mais si ça marche, (et le cochon a beaucoup de similitudes avec le corps humain), Carmat peut se faire du mouron pour l’avenir.
On dit toujours que tout est bon dans le cochon. Ça va bien au-delà.
On dit aussi que dans le coeur d’un homme, il y a un cochon qui sommeille.
Une fois le coeur prélevé , sans étés d'âmes, les reste du cochon sera transformé en saucisses , sans problème. Tout bénèf.
|
Répondre
|
Des annonces devraient avoir lieu en janvier 2022.
En attendant, il n'y a plus d'acheteurs du titre donc mécaniquement les cours baissent pour trouver preneur
Pour l'instant, pas de mauvaises nouvelles concernant les patients transplantés donc ça semble être un signal positif sur l'efficacité et la fiabilité du dispositif
|
Répondre
|
Support 18.94
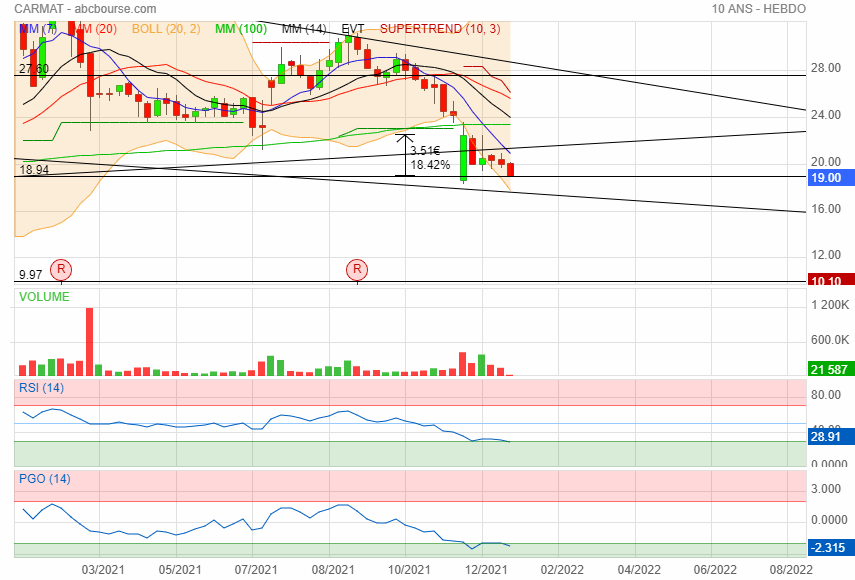
|
Répondre
|
 2
2
December 23, 2021 01:00 AM Eastern Standard Time PARIS - (BUSINESS WIRE)--Regulatory News :
►CARMAT annonce la fin de ses investigations sur les problèmes de qualité précédemment identifiés
CARMAT (FR0010907956, ALCAR, éligible PEA-PME), concepteur et développeur du cœur artificiel total le plus avancé au monde, visant à offrir une alternative thérapeutique aux malades souffrant d’insuffisance cardiaque biventriculaire terminale, annonce la fin de ses investigations sur les problèmes de qualité précédemment identifiés.
Suite à la survenance d’un problème qualité ayant affecté certaines de ses prothèses, CARMAT avait annoncé, le 3 décembre 2021, la suspension volontaire et temporaire des implantations de son cœur artificiel Aeson®. La société a ensuite mené une investigation très rigoureuse de la situation.
Cette investigation, aujourd'hui terminée, a permis d'identifier l’origine du problème de qualité, et de déterminer les changements requis pour éviter qu’il ne se reproduise.
Les résultats de cette investigation vont être partagés, à partir de cette semaine, avec l'organisme notifié (DEKRA) et les autorités compétentes (l'ANSM en France et la Food & Drug Administration aux Etats-Unis). Les discussions avec DEKRA et les autorités compétentes pourraient durer quelques semaines et devraient aboutir à un accord sur le calendrier de reprise des implantations.
La société prévoit de faire un nouveau point en janvier 2022, y compris dans le cadre d'une webconférence, dont la date sera communiquée ultérieurement.
[...]
https://
www.businesswire.com/news/home/20211222005521/fr
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !