Consolidation interressante
Cours temps réel: 4,714 -0,13%| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
 0
0
G une seule action dans mon portefeuille; vla
Une seconde en surveillance opportuniste; metex
toutes 2 m'ont bien enrichi
curieusement, à l'instant metex prend 11% après annonce; Metabolic Explorer alerte sur une trésorerie en tension
vla ne prend QUE 4% après une super annonce
simple observation factuelle
|
Répondre
|
 0
0
VALNEVA : LES ÉTATS-UNIS APPROUVENT LE PREMIER VACCIN CONTRE LE CHIKUNGUNYA
Le vaccin, qui sera commercialisé sous le nom de Ixchiq, est autorisé pour les personnes de 18 ans et plus, présentant un risque accru d'être exposées au virus, a précisé l'agence américaine des médicaments (FDA), dont les décisions sont très suivies dans le monde, rappelle l'Agence France-Presse.
Message complété le 10/11/2023 06:55:13 par son auteur.
Aujourd’hui, la Food and Drug Administration des États-Unis a approuvé Ixchiq, le premier vaccin contre le chikungunya. Ixchiq est approuvé pour les personnes âgées de 18 ans et plus qui présentent un risque accru d’exposition au virus du chikungunya.
Le virus du chikungunya se transmet principalement à l’homme par la piqûre d’un moustique infecté. Le chikungunya est une menace émergente pour la santé mondiale, avec au moins 5 millions de cas d’infection par le virus du chikungunya signalés au cours des 15 dernières années. Le risque d’infection est le plus élevé dans les régions tropicales et subtropicales d’Afrique, d’Asie du Sud-Est et de certaines parties des Amériques où les moustiques porteurs du virus du chikungunya sont endémiques. Cependant, le virus du chikungunya s’est propagé à de nouvelles zones géographiques, provoquant une augmentation de la prévalence mondiale de la maladie.
Les symptômes les plus courants du chikungunya sont la fièvre et les douleurs articulaires. D’autres symptômes peuvent inclure une éruption cutanée, des maux de tête et des douleurs musculaires. Certaines personnes peuvent ressentir des douleurs articulaires débilitantes qui persistent pendant des mois, voire des années. Le traitement comprend du repos, des liquides et des médicaments en vente libre pour la douleur et la fièvre.
« L’infection par le virus du chikungunya peut entraîner une maladie grave et des problèmes de santé prolongés, en particulier pour les personnes âgées et les personnes souffrant de problèmes de santé sous-jacents », a déclaré Peter Marks, M.D., Ph.D., directeur du Centre d’évaluation et de recherche sur les produits biologiques de la FDA. « L’approbation d’aujourd’hui répond à un besoin médical non satisfait et constitue une avancée importante dans la prévention d’une maladie potentiellement débilitante dont les options de traitement sont limitées. »
Ixchiq est administré en une seule dose par injection dans le muscle. Il contient une version vivante et affaiblie du virus du chikungunya et peut provoquer chez le vacciné des symptômes similaires à ceux ressentis par les personnes atteintes de la maladie du chikungunya.
L’innocuité d’Ixchiq a été évaluée dans le cadre de deux études cliniques menées en Amérique du Nord au cours desquelles environ 3 500 participants âgés de 18 ans et plus ont reçu une dose du vaccin, et une étude a porté sur environ 1 000 participants ayant reçu un placebo. Les effets secondaires les plus fréquemment signalés par les personnes vaccinées étaient des maux de tête, de la fatigue, des douleurs musculaires, des douleurs articulaires, de la fièvre, des nausées et une sensibilité au site d’injection.
De plus, bien qu’ils ne soient pas fréquemment rapportés, des effets indésirables graves de type chikungunya qui ont empêché l’activité quotidienne et/ou nécessité une intervention médicale sont survenus chez 1,6 % des receveurs d’Ixchiq et aucun des receveurs du placebo. Deux receveurs présentant des effets indésirables sévères de type chikungunya ont été hospitalisés. De plus, certains receveurs ont eu des effets indésirables prolongés de type chikungunya qui ont duré au moins 30 jours. L’information posologique comprend une mise en garde indiquant que le vaccin peut provoquer des effets indésirables graves ou prolongés semblables à ceux du chikungunya.
La FDA exige de la société qu’elle mène une étude post-commercialisation pour évaluer le risque sérieux d’effets indésirables graves de type chikungunya après l’administration d’Ixchiq.
La transmission du virus du chikungunya aux nouveau-nés par des femmes enceintes atteintes de virémie (virus présent dans le sang) à l’accouchement a été signalée et peut provoquer une maladie à virus du chikungunya grave, potentiellement mortelle, chez les nouveau-nés. Dans une étude qui a évalué si le virus vaccinal était présent dans le sang après la vaccination, la plupart des personnes avaient détecté le virus vaccinal dans le sang au cours de la première semaine suivant la vaccination ; Le virus vaccinal n’a pas été détecté 14 jours après la vaccination. Les renseignements posologiques comprennent une mise en garde indiquant qu’on ne sait pas si le virus vaccinal peut être transmis des personnes enceintes aux nouveau-nés, ni si le virus vaccinal peut causer des effets indésirables chez le nouveau-né. La mise en garde indique également que lorsqu’ils envisagent l’administration à des personnes enceintes, les fournisseurs de soins de santé doivent prendre en considération le risque d’exposition au virus du chikungunya, l’âge gestationnel et les risques pour le fœtus ou le nouveau-né de la maladie causée par le virus du chikungunya chez la personne enceinte.
L’efficacité d’Ixchiq est basée sur les données de réponse immunitaire d’une étude clinique menée aux États-Unis chez des personnes âgées de 18 ans et plus. Dans cette étude, la réponse immunitaire de 266 participants ayant reçu le vaccin a été comparée à la réponse immunitaire de 96 participants ayant reçu un placebo. Le niveau d’anticorps évalué chez les participants à l’étude était basé sur un niveau qui s’est avéré protecteur chez les primates non humains qui avaient reçu du sang de personnes vaccinées. Presque tous les participants à l’étude vaccinale ont atteint ce niveau d’anticorps.
Ixchiq a été approuvé à l’aide de la voie d’approbation accélérée. L’approbation accélérée permet à la FDA d’approuver certains produits pour des affections graves ou potentiellement mortelles sur la base de preuves de l’efficacité d’un produit qui sont raisonnablement susceptibles de prédire un bénéfice clinique. Dans l’évaluation d’Ixchiq par la FDA en vue d’une approbation accélérée, les preuves d’efficacité sont basées sur les données de réponse immunitaire chez les participants aux essais cliniques. Comme condition d’approbation d’Ixchiq, la FDA exige que des études cliniques de confirmation soient menées pour vérifier le bénéfice clinique.
Ixchiq a obtenu les désignations Fast Track et Breakthrough Therapy et la demande a fait l’objet d’un examen prioritaire. En outre, la FDA a accordé au fabricant d’Ixchiq un bon d’examen prioritaire des maladies tropicales, en vertu d’une disposition incluse dans la loi de 2007 portant modification de la loi sur la Food and Drug Administration. Cette disposition vise à encourager le développement de nouveaux médicaments et produits biologiques pour la prévention et le traitement de certaines maladies tropicales.
La FDA a accordé l’autorisation d’Ixchiq à Valneva Austria GmbH.
|
Répondre
|
Accord du vaccin par la FDA
|
Répondre
|
 0
0
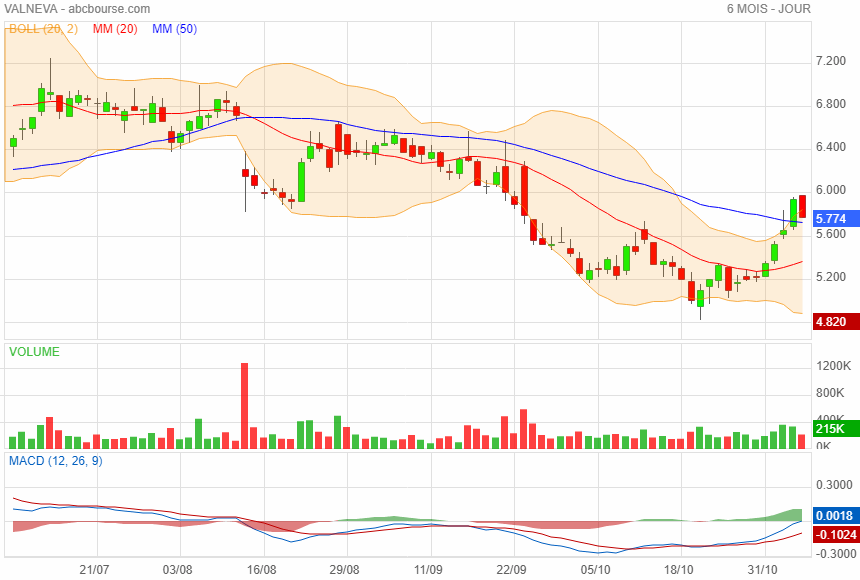
Dans un faible volume avec retour dans les bolls et au dessus MM50
A suivre...
Message complété le 09/11/2023 09:45:25 par son auteur.
Il me semble avoir eu raison, pru retrouvé
J attends entre 4
0.000 et 50.000 Euros de PV en fin de mois
Cordial'micalement
Message complété le 09/11/2023 11:36:25 par son auteur.
Valneva monte de 1% à 6,10 euros ce jeudi, alors que le groupe a publié 106,1 millions de ventes de produits sur 9 mois, soit une hausse de 42,6% par rapport aux neuf premiers mois de 2022. Les ventes d'IXIARO et de DUKORAL ont bénéficié de la reprise continue du marché des voyageurs. Le Chiffre d'affaires total est de 111,8 millions d'euros sur les 9 premiers mois de 2023. La position de trésorerie ressort à 171,3 millions d'euros au 30 septembre.
Le groupe rappelle qu'une demande d'autorisation de mise sur le marché (AMM) fait actuellement l'objet d'un examen prioritaire par la Food and Drug Administration (FDA) des États-Unis avec une date-cible pour achever cet examen fixée à la fin novembre;
Une demande d'AMM fait également l'objet d'un examen par Santé Canada;
Une demande d'AMM a été déposée auprès de l'Agence européenne des médicaments (EMA) en octobre 20232 ; une revue accélérée a été accordée par le Comité des médicaments à usage humain (CHMP) de l'EMA.
Perspectives financières actualisées pour l'exercice 2023 liées à des dépenses de 'R&D' moins importantes qu'anticipées
Le Chiffre d'affaires total et autres produits opérationnels est attendu entre 220 millions et 260 millions d'euros, dont :
130 millions à 150 millions de ventes de produits
90 millions à 110 millions d'autres produits opérationnels (dans l'hypothèse d'une vente du bon d'examen prioritaire reçu dans le cadre d'une approbation potentielle de VLA1553 avant la fin de l'année).
Les dépenses de 'R&D' sont désormais attendues entre 60 millions et 70 millions (précédemment entre 70 millions et 90 millions); principalement en raison de coûts moins élevés que prévu liés à la clôture des activités du programme COVID-19.
Portzamparc parle d'une bonne dynamique commerciale. A court terme, le catalyseur est clairement sur le chikungunya. L'analyste relève à cette occasion son cours cible de 9,5 à 10,1 euros en restant à l'achat sur le dossier.
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !