CROSSJECT - News - Reco - Page 10
Cours temps réel: 2,35 0,43%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
📈📈📈 Bientôt la question se posera : quand prendre ses bénéfices ❓❓❓
🫣
|
Répondre
|
Crossject : Syneos Health engagé pour Zepizure aux Etats-Unis
Le 05 janvier 2024 à 09:00
Crossject annonce avoir engagé Syneos Health, groupe de services aux laboratoires biopharmaceutiques, pour la préparation au lancement commercial aux États-Unis du Zepizure, son traitement d'urgence innovant dans la prise en charge des crises d'épilepsie.
Dans le cadre de cet accord, Syneos Health apportera son soutien pour toutes les activités de pré-lancement et de lancement du produit, faisant bénéficier Crossject de sa présence aux États-Unis et son expertise dans la mise sur le marché de nouveaux traitements.
|
Répondre
|
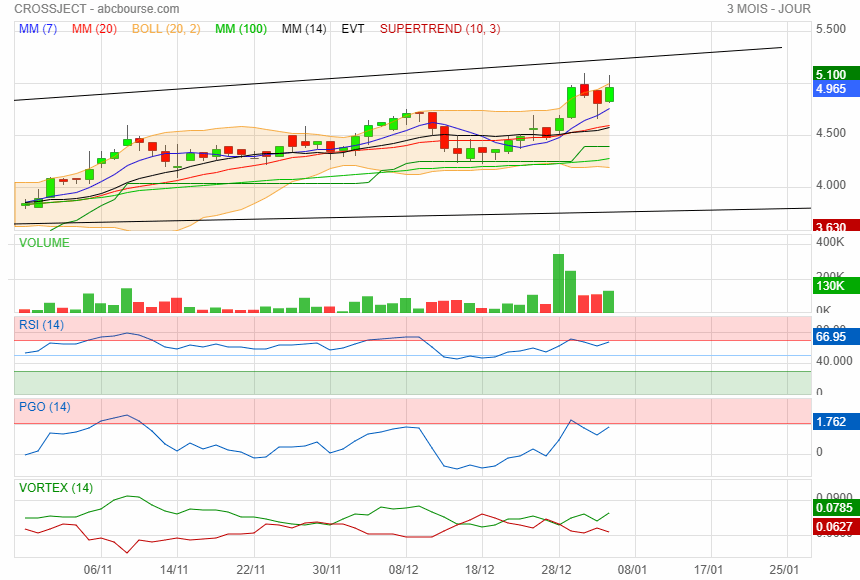
Pour l'instant tout ce passe bien
nette augmentation des volumes ces derniers jours
en moyenne plus de 100 000 titres/J et je ne tiens pas compte de l ordre de 190 000 titres échangés il y à 5 jours
à suivre ...
|
Répondre
|
Crossject signe un nouvel accord de distribution en Europe du Nord
Le 03 janvier 2024 à 09:36
Au-delà de la commande ferme du BARDA (Biomedical Advanced Research and Development Authority) aux Etats-Unis et d’un accord de commercialisation pour l’Australie et la Nouvelle-Zélande, Crossject annonce avoir signé un accord de commercialisation en Europe du Nord pour ZEPIZURE (ex Midazolam). La nouvelle ne devrait pas avoir d’impact sur nos prévisions, ces dernières s’appuyant sur les produits effectivement lancés.
ACTUALITÉ
Crossject a annoncé la signature d’un accord de commercialisation en Europe du Nord pour ZEPIZURE (anciennement ZENEO Midazolam) couvrant l’Allemagne, le Royaume-Uni, le Danemark, la Suède, la Finlande et la Norvège.
ANALYSE
Même si le partenaire de cet accord n’a pas été communiqué et que, par conséquent, son envergure comme sa “puissance en termes de distribution” ne sont pas connues, il s’agit d’une bonne nouvelle pour le groupe français dont les produits seront accessibles à une population de 170m d’habitants. Sur le plan financier, Crossject percevra des paiements échelonnés pouvant représenter jusqu’à 1m€ en tout, une fois les autorisations de mise sur le marché obtenues dans les pays concernés par l’accord, ainsi qu’un pourcentage de la marge brute réalisée. Selon les termes de l’accord, Crossject assumera les coûts de développement réglementaire et détiendra toutes les autorisations de mise sur le marché qui en résulteront. Le partenaire supportera pour sa part les coûts commerciaux.
La nouvelle arrive après la commande ferme passée par la BARDA (Biomedical Advanced Research and Development Authority), et la signature de l’autre accord de commercialisation pour l’Australie et la Nouvelle-Zélande (avec AF Pharmaceuticals couvrant une population d’environ 30m d’habitants).
Ces deux accords et la commande passée aux États-Unis (BARDA) confirment que le groupe progresse vers la commercialisation de Zepizure et qu’il se met en ordre de marche en vue du lancement du produit dans ces régions une fois que les autorisations de mise sur le marché auront été obtenues.
IMPACT
La nouvelle ne devrait pas avoir d’impact nos prévisions, ces dernières s’appuyant sur les produits effectivement lancés. Comme pour les autres accords, le partenaire supportera une partie des coûts du groupe liés au développement et participera aux dépenses liées aux demandes de mise sur le marché.
|
Répondre
|
c est un diesel ca part doucement

|
Répondre
|
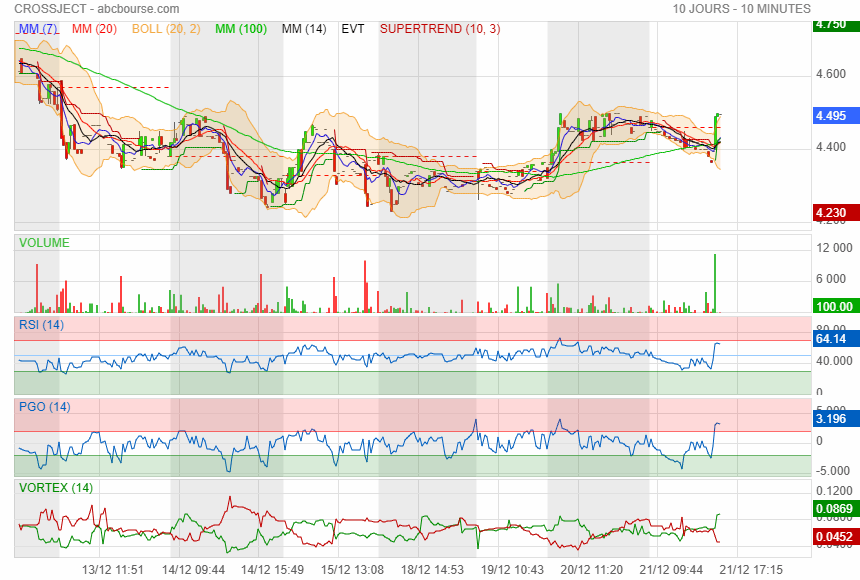
De bonne augure pour la suite
Message complété le 22/12/2023 09:09:34 par son auteur.
encore un au courant avant les autres !!!!
|
Répondre
|
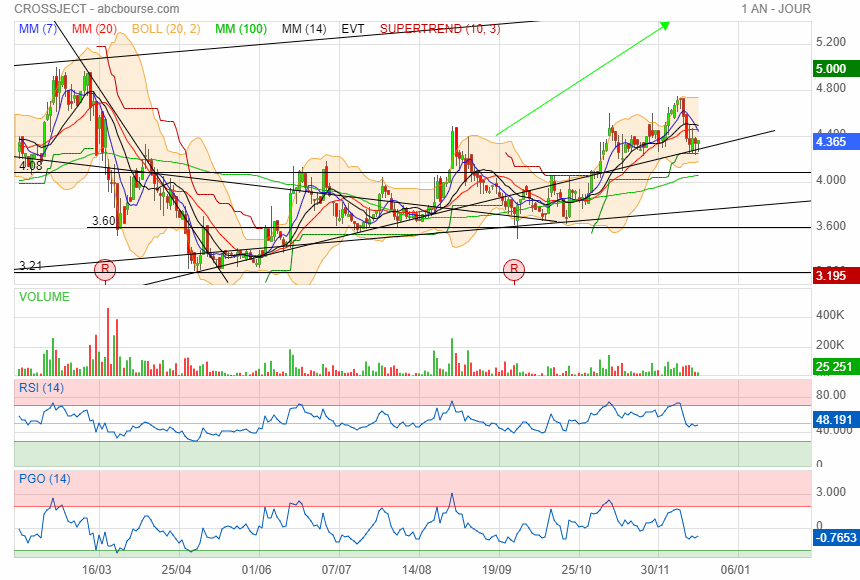
Crossject sur support oblique
|
Répondre
|
Crossject : du soutien !
28/11/2023
Crossject : du soutien !
Crossject, société pharmaceutique spécialisée qui développe des auto-injecteurs sans aiguille dédiés aux situations d'urgence, annonce l'initiation de couverture de son titre par des analystes du groupe financier indépendant ODDO BHF.
Les analystes d'ODDO BHF ont attribué à Crossject la recommandation "Surperformance" avec un objectif de cours de 7,10 euros, faisant valoir les avantages considérables apportés par le dispositif sans aiguille ZENEO de l'entreprise, qui permet aux patients et aux soignants non formés d'administrer facilement des injections en une fraction de seconde dans des situations d'urgence.
Le contrat de Crossject avec l'Autorité américaine pour la 'R&D' avancée dans le domaine biomédical (la BARDA) portant sur la fourniture de ZEPIZURE, précédemment connu sous le nom de ZENEO Midazolam, dans le traitement des crises d'épilepsie causées par des agents neurotoxiques, constitue une validation importante de la plateforme d'après les analystes.
"Le groupe a su démontrer son expertise et se différencier de ses concurrents grâce à son dispositif sans aiguille ZENEO. Le marché des médicaments injectables représente plus de 20% du marché pharmaceutique, dynamisé par le secteur de l'auto-injection. Nous voyons dans cette innovation une réelle amélioration du confort du patient et l'assurance d'une injection efficace, notamment dans les situations d'urgence ont déclaré Martial Descoutures et Oussema Denguir, analystes chez ODDO BHF. "Avec une commande ferme de 60 M$ pour son premier produit candidat ZENEO Midazolam, nous prévoyons les premières ventes à partir de 2024, sous réserve d'une approbation fin 2023/début 2024. Nous prenons également en compte les deux candidats prioritaires du groupe qui seront lancés sur le marché entre 2024 et 2026 et considérons le reste du portefeuille clinique comme une option gratuite."
Cette nouvelle initiation complète la couverture de Crossject par les analystes d'Invest Securities et d'Alpha Value.
|
Répondre
|
j ai pas tout a fait la mémé appréciation de ces dires
petit a petit l oiseau fait son nid
nouvelle usine
2023 est l’année où Crossject devient une entreprise à l’échelle industrielle et commerciale !
Le contrat signé avec BARDA, au-delà de sa valeur de 155 millions de dollars, signifie pour Crossject un changement de position dans la chaîne de valeur. Nous allons, dès cette année, livrer directement un client. Jusqu’alors, nous étions dans un cycle R&D, avec l’accent mis sur la production de lots destinés aux dossiers d’enregistrements. Grâce au contrat, notre production pivote vers la fabrication de lots commerciaux, 800 000 unités sur 3 ans.
Cela demande à l’entreprise une évolution générale. Nous devons certes produire ce qui est promis mais aussi livrer, documenter et facturer.
Le contrat BARDA a une autre vertu. Dans la mesure où la commande est assortie de financements et d’assistance à la mise sur le marché accéléré de ZENEO® Midazolam, nous entrons dans une nouvelle séquence économique. Nous ne prétendons plus dépendre des marchés financiers pour alimenter notre fonctionnement et nos investissements. Notre « carburant » est désormais la réalisation d’un chiffre d’affaires significatif et la capacité à lever de la dette bancaire. Dans l’état complexe du financement de l’innovation santé aujourd’hui, c’est évidemment une heureuse perspective pour Crossject.
|
Répondre
|
... Depuis le temps que je la traîne... Je commence à ne plus trop y croire. 😟
|
Répondre
|
"Si on arrive à facturer à la fin de cette année ou au début de l'année prochaine,"........
C'est un aveu plutôt inquiétant...Une entreprise qui "ne peut pas facturer" est morte d'avance....Cela signifie que son produit est invendable, même s'il est techniquement très élaboré comme par ex: Concorde...
|
Répondre
|
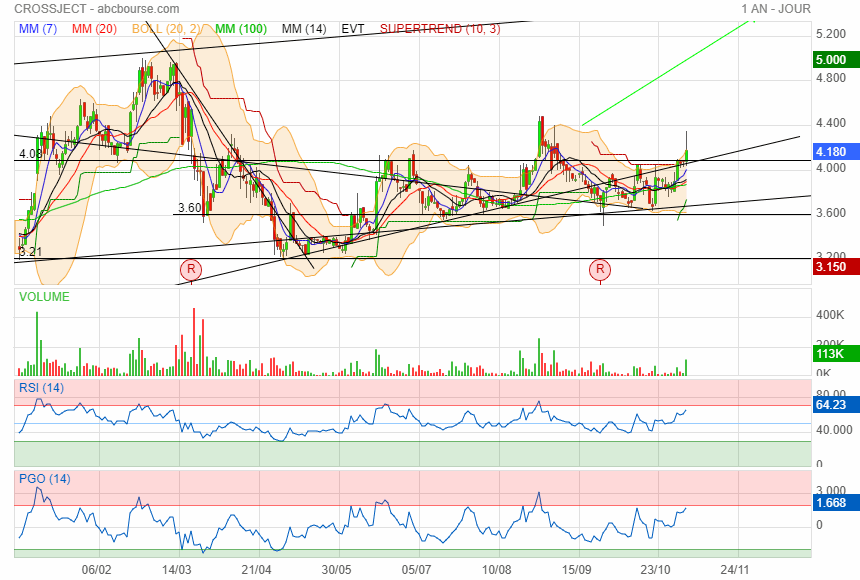
Avec mes lignes j ai coincé le cours à 4.08 !
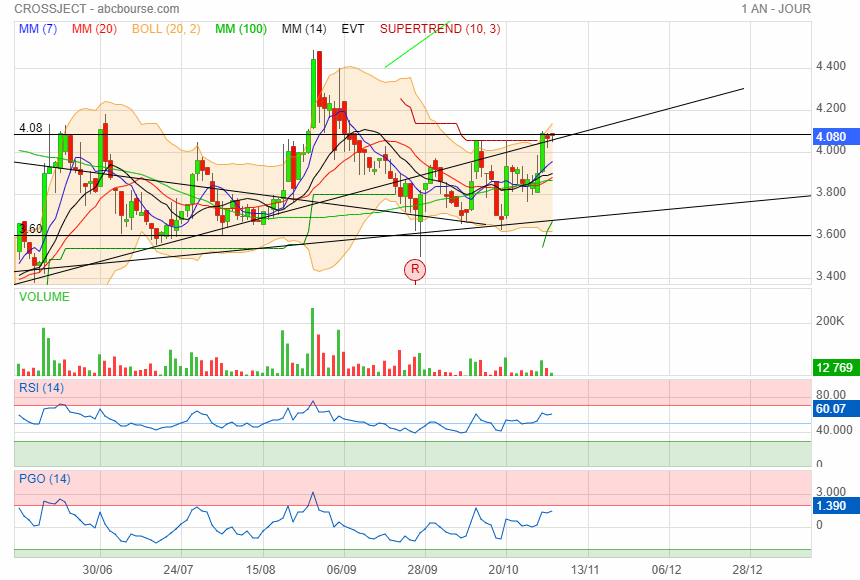
|
Répondre
|
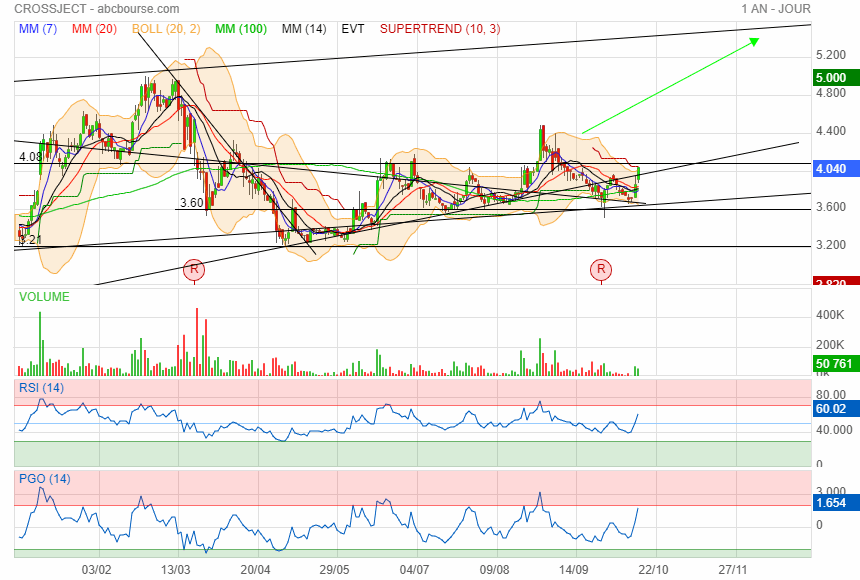
Avec un peu de retard ....
10 octobre 2023 15 h 35 min
Patrick Alexandre Président du Directoire Crossject : "Si on arrive à facturer à la fin de cette année ou au début de l'année prochaine, on devrait avoir un résultat positif en 2024".
Rencontres avec les dirigeants
|
Répondre
|
Publié le 05/09/2023 à 07h46
Crossject annonce avoir passé avec succès des audits européens et américain pour la fabrication de ZENEO Midazolam dans le traitement des crises d'épilepsie
(Boursier.com) — Crossject , société pharmaceutique spécialisée qui développe et commercialisera prochainement un portefeuille de produits combinés dédiés aux situations d'urgence, annonce que ses sites de production de Dijon et Gray ont passé avec succès un audit annuel de certification ISO, ont élargi leur champ de certification par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), et ont reçu une conclusion positive à la suite de l'audit conduit par l'Autorité américaine pour la 'R&D' avancée dans le domaine biomédical (la BARDA), relevant du Bureau du Secrétaire adjoint à la préparation et à l'intervention au sein du département de la Santé et des Services sociaux des États-Unis, sur la conformité de la fabrication de ZENEO Midazolam pour le marché américain.
Ces rapports positifs des deux côtés de l'Atlantique démontrent les standards rigoureux des systèmes fabrication et qualité appliqués par Crossject. Ils sont essentiels pour garantir la qualité de nos produits et les commercialiser en Europe et aux États-Unis", a déclaré Patrick Alexandre, Président Directeur Général de Crossject. "ZENEO Midazolam offrira une nouvelle méthode simple et fiable pour administrer un traitement vital d'urgence dans la prise en charge de la crise épileptique. Ces certifications permettront à Crossject de continuer de développer sa capacité de production pour devenir un leader mondial de l'auto-administration d'urgence et sans aiguille de médicament injectable."
Dans le cadre du contrat avec la BARDA, des audits préparatoires ont été menés afin d'évaluer la conformité aux BPFa exigée par les règles de la Food and Drug Administration (FDA) des États-Unis, et évaluer le niveau de préparation en vue d'un éventuel audit de la FDA. L'audit n'a relevé aucune observation critique ou majeure.
Les sites Crossject de Dijon et Gray répondent à toutes les exigences réglementaires des Systèmes qualité et des BPFa concernant la production et le contrôle de l'auto-injecteur Crossject. La société a signé auparavant un contrat de 60 millions de dollars avec la BARDA pour la fourniture de ZENEO Midazolam, dès l'autorisation de la FDA. Selon les termes du contrat, la BARDA a également la possibilité d'acheter des unités supplémentaires, pour un montant maximum de 59 millions de dollars. La valeur contractuelle totale, si toutes les options sont exercées, s'établit à 155 millions de dollars.
Par ailleurs, l'organisme notifié British Standards Institution (BSI) a procédé à un audit annuel des systèmes qualité de Crossject et a renouvelé sa certification ISO 13485, démontrant ainsi la conformité aux normes internationales sur l'ensemble du cycle de vie du système d'injection sans aiguille ZENEO pour ses deux sites de production en France, à Dijon et à Gray.
En outre, l'Agence nationale de sécurité du médicament (ANSM) a étendu l'autorisation de fabrication de Crossject : initialement limitée aux essais cliniques, elle permet désormais la fabrication à des fins commerciales.
|
Répondre
|
Elle se réveille !
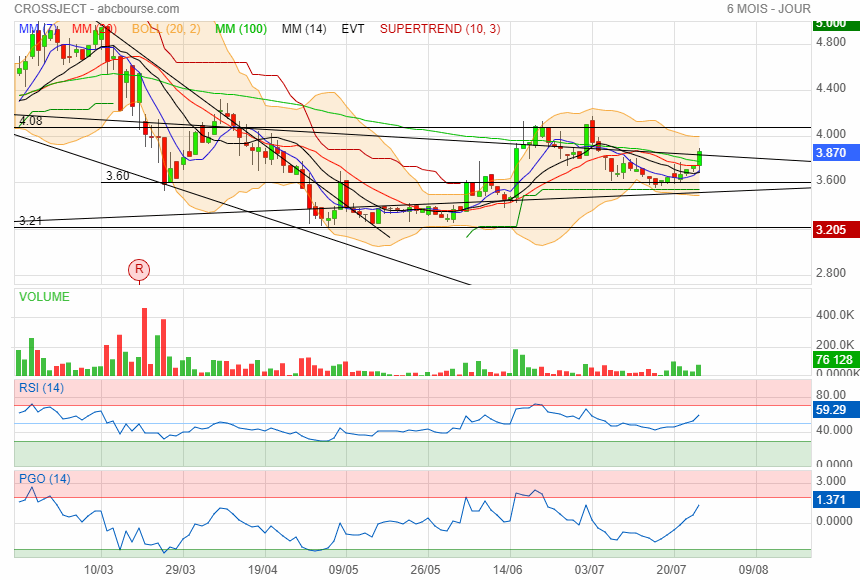
|
Répondre
|
il y a un an elle faisait 120 %
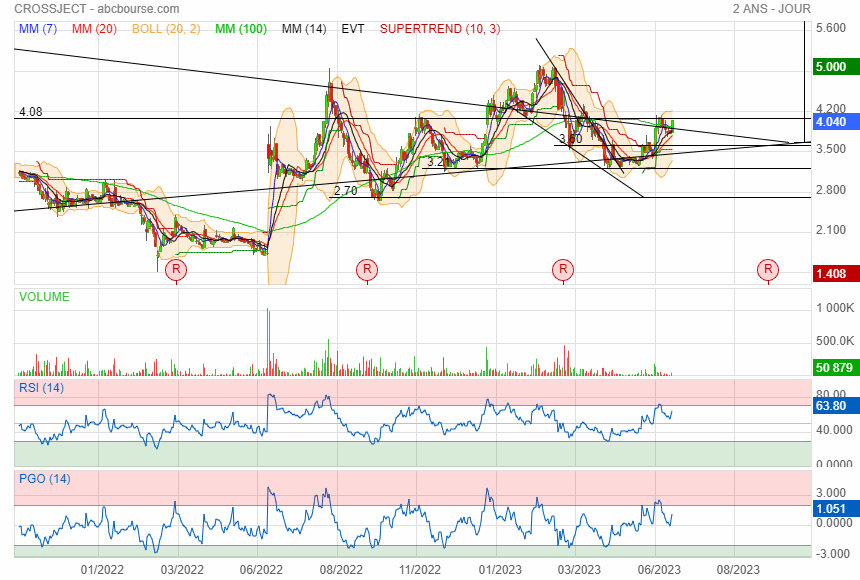
|
Répondre
|
Ordre de 20000 juste avant la clôture
20/06/2023 17:28 4.06 4.1 4.1 4.06 20123 23 EUR
20/06/2023 17:35 4.09 4.09 4.09 4.09 1063 7 EUR
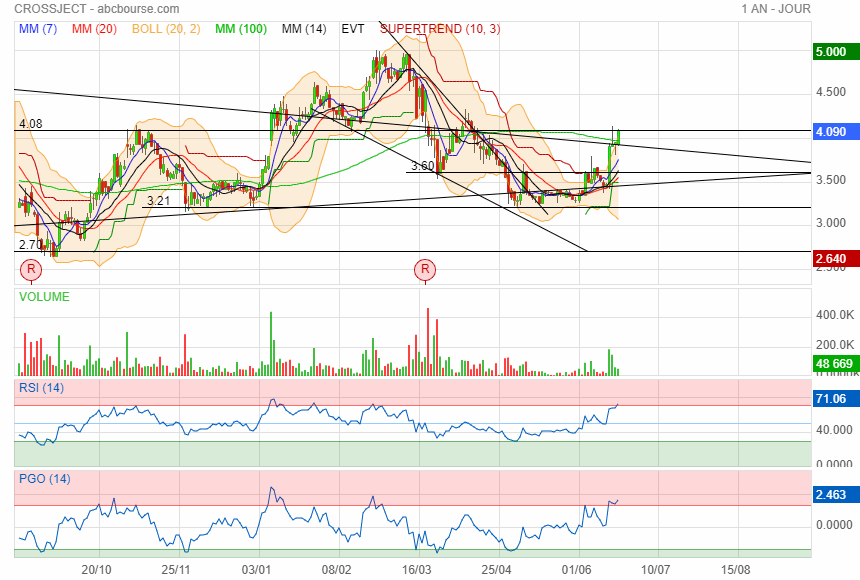
|
Répondre
|
Jolie rebond
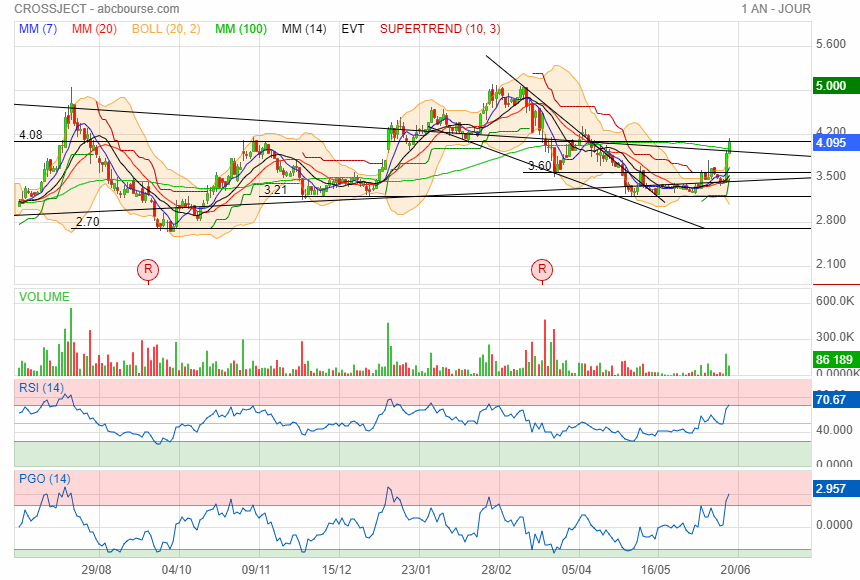
|
Répondre
|
Quelques news...
|
Répondre
|
@ Ricoco01
11,40 oui, c'est pour le moins ambitieux !
Mais ils ne disent pas à quelle échéance .....
|
Répondre
|

 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !