Valneva: contrôle direct des ventes d'Ixiaro aux Etats-Unis. - Page 4
Cours temps réel: 4,81 1,91%| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
J'ai augmenté ma ligne sur PEA 2 à 3805 : achat de 2500 à 4,103 de PRU.
sur PEA 1, j'ai profité de la vente de 1400 Société générale pour en prendre une grosse louche : 2700 vers (4,13 + frais).
|
Répondre
|
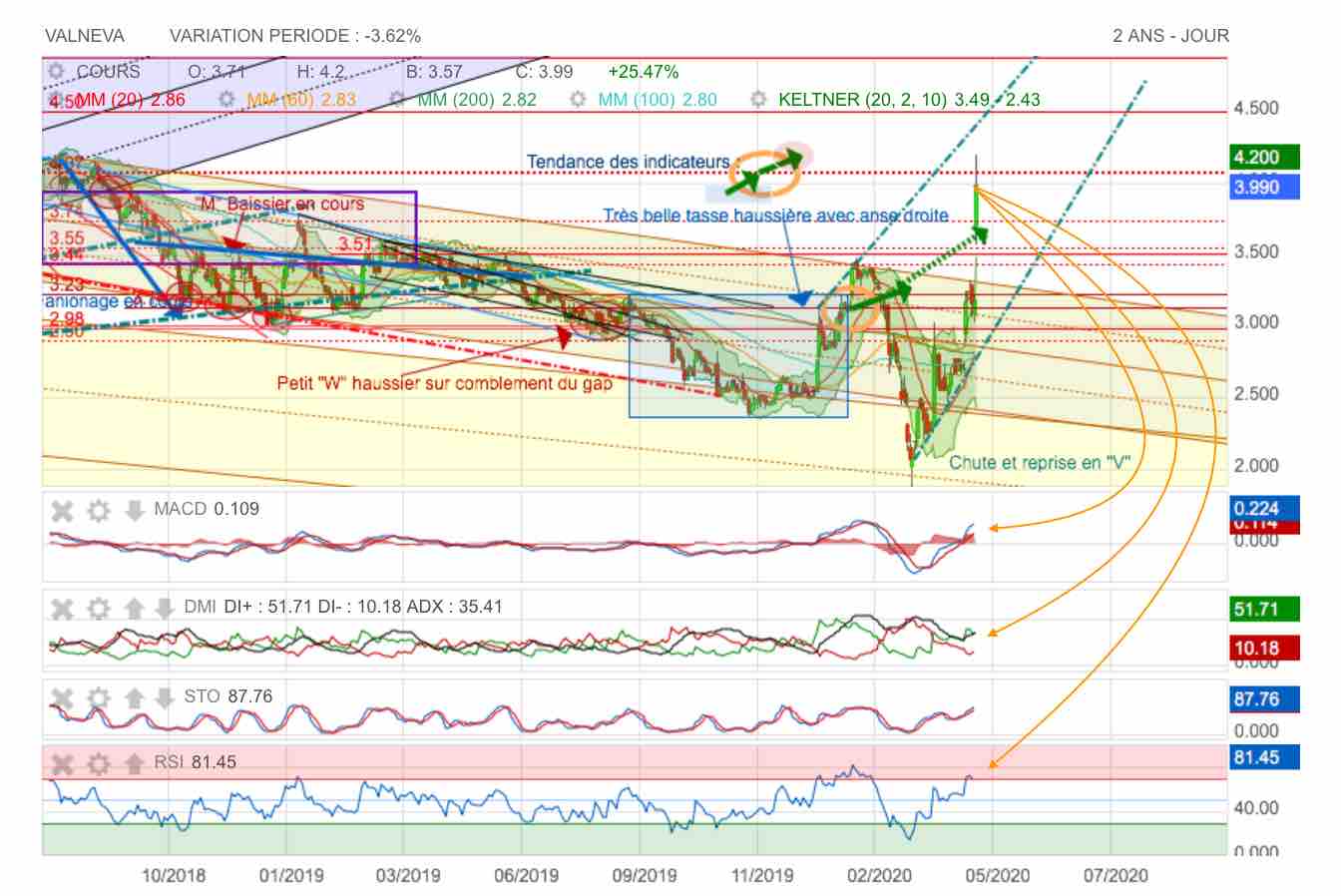
Explosion à la hausse sur fond de reprise "V" juste après la tasse que j'avais annoncé.
On se retrouve finalement avec 2 figures haussières consécutives.
Comme on le voit dans les posts précédents, l'actualité change beaucoup à quelques jours de la publication des résultats trimestriels.
ça devrait aider la publication trimestrielle attendue un peu moindre à passer comme une lettre à la boite...
Coté graphe : c'est haussier partout ! et ça monte sévère...
.
|
Répondre
|
Quelle nouvelle !... enfin, une reconnaissance du travail accompli pour l'une des plus méritante PME de recherche vaccinale.
Valneva : Pfizer va verser 130 millions de dollars au français Valneva pour son vaccin anti-Lyme
Actualités 30 avuil 2020 | 12:02
NOTONS QUE :
L'un des plus gros accords pour une biotech française
Grâce à un accord avec Pfizer -l'un des plus importants jamais annoncés par une biotech tricolore- Valneva accède à une reconnaissance majeure de la valeur de son candidat vaccin (désigné pour l'heure VLA15) qui vise à combattre la maladie en ciblant l'enveloppe d'une protéine (OspA) fréquemment exprimée par les bactéries de type Borrelia qui provoquent la borréliose de Lyme.
À ce jour, VLA15 est en effet le seul programme au monde suffisamment avancé pour faire l'objet d'essais chez l'homme. Lors des essais précliniques et en phase 1 (où est principalement vérifiée l'innocuité), le vaccin a donné de premiers résultats favorables en termes d'immunogénicité et l'agence de santé américaine lui a accordé le statut de "Fast track". Deux études de phase 2 (essais cliniques intermédiaires) sont pratiquement bouclées, Valneva ayant finalisé le recrutement et le suivi sur de plus de 800 patients, et compte être en mesure d'annoncer les résultats prochainement, soit mi-2020.
Le géant américain Pfizer (actuellement numéro 5 mondial par sa capitalisation dans son secteur) a choisi de ne pas attendre jusque-là, et a conclu un accord de collaboration avec Valneva pour le développement et le cas échéant la commercialisation du vaccin, a annoncé la biotech jeudi matin.
Jusqu'à 308 millions de dollars à la clé
Valneva pourra recevoir des paiements d’un montant total de 308 millions de dollars dont un paiement initial de 130 millions de dollars (l'un des plus importants jamais accordés à une biotech tricolore, le record appartenant à Innate avec 250 millions de dollars), puis des paiements d’étape de 35 millions de dollars liés à l’avancée du développement du produit et jusqu’à 143 millions de versements liés à des jalons commerciaux. En cas de mise sur le marché, Pfizer versera en outre des redevances à Valneva, avec un taux débutant à 19%. L'américain financera de plus 70% des coûts de développement.
"La maladie de Lyme est la maladie transmise par les tiques la plus fréquente aux États-Unis avec une prévalence et une portée géographique qui ne cessent de croître. Nous avons hâte de travailler en étroite collaboration avec Valneva sur l’avancée du programme VLA15 et de pouvoir potentiellement apporter une nouvelle solution aux patients pour répondre à ce besoin médical important", a indiqué Nanette Cocero, la patronne mondiale de la branche Pfizer Vaccines.
Pour le directeur général de Valneva, Thomas Lingelbach, cette collaboration "offre l’opportunité d’un développement et d’un lancement rapides d’un vaccin pouvant répondre à un besoin médical très important et non satisfait. Elle valide également les fortes compétences de Valneva en matière de R&D dans les vaccins. Nous pensons que Pfizer est le meilleur partenaire pour notre vaccin contre la maladie de Lyme compte tenu de ses capacités exceptionnelles de développement et de commercialisation. Notre équipe est extrêmement enthousiaste à l’idée de travailler avec un partenaire aussi performant". Pfizer est notamment à l'origine d'un des seuls vaccins, Ticovac, contre l’encéphalite à tiques (TBE), une maladie heureusement plus rare (elle peut être la cause de décès ou laisser des séquelles neurologiques).
En Bourse, l'annonce entraînait un bond de 27,99% à 4,07 euros du cours de Valneva, correspondant à une augmentation de sa capitalisation de 80 millions d'euros. "
|
Répondre
|
Coronavirus. Valneva sur la piste d’un vaccin
La société basée à Saint-Herblain, dont l’un des actionnaires principaux est le Groupe Grimaud de Roussay, près de Cholet, s’associe à un laboratoire américain en vue de développer un vaccin contre le Covid-19. Premiers essais cliniques prévus avant la fin 2020.
|
Répondre
|
Valneva se lance dans la course au vaccin contre le Covid-19
Publié Le 29/04/2020 - 09:30
https://www.brefeco.com/actualite/sante/valneva-se-lance-dans-la-course-au-vaccin-contre-le-covid-19
Valneva espère pouvoir initier des essais cliniques avant la fin 2020 pour un vaccin contre le Covdid-19.
La société de vaccins spécialisée dans la prévention des maladies engendrant des besoins médicaux importants ou non satisfaits, Valneva, annonce sa collaboration avec Dynavax pour le développement d’un vaccin contre le Covid-19.
Plutôt connue pour ses vaccins contre les maladies du voyageur (encéphalite japonaise et choléra) et son...
|
Répondre
|
Merci pour ta contribution enrichissante à la file !
|
Répondre
|
Message complété le 24/03/2020 15:39:52 par son auteur.
Message complété le 24/03/2020 15:40:43 par son auteur.
Paris (awp/afp) - Le groupe franco-autrichien Valneva, spécialiste des vaccins, a prévenu mardi que la crise du coronavirus lui coûterait entre 20 et 40 milions d'euros (21 à 42 millions de francs suisses) cette année, car son activité dépend beaucoup de vaccins administrés à l'occasion de voyages internationaux désormais très limités.
"Bien qu'il soit difficile de prévoir l'impact précis de cette crise, (...) nous estimons que nos ventes de vaccins du voyage seront fortement impactées", a déclaré dans un communiqué Thomas Lingelbach, directeur général du groupe.
Le groupe dépend en effet beaucoup des ventes de deux vaccins administrés en cas de voyages dans certaines régions du monde, l'un contre le choléra et la diarrhée du voyageur, l'autre contre l'encéphalite japonaise.
Or, les voyages internationaux sont drastiquement réduits par les multiples mesures prises par les Etats contre la propagation du coronavirus.
En conséquence, Valneva, qui s'attendait à un chiffre d'affaires compris entre 125 et 135 millions d'euros cette année, prévoit maintenant qu'il sera inférieur de 30 à 40 millions d'euros à cette prévision.
Le groupe, qui prévoyait déjà une perte d'exploitation cette année, pense aussi qu'elle sera pire que prévu, d'environ 50 millions d'euros.
En plus des effets immédiats, il doit reporter de plusieurs mois le déroulement des tests d'un possible vaccin contre le chikungunya. En revanche, les essais d'un autre vaccin, contre la maladie de Lyme, seront peu affectés mais sont à un stade très précoce.
Rare point positif, la crise "pourrait avoir un effet positif à moyen ou long terme sur le marché des vaccins en raison d'une sensibilisation accrue à la vaccination", avance M. Lingelbach.
|
Répondre
|
Valneva : la FDA approuve une prolongation de la durée d'utilisation du vaccin IXIARO® à 36 mois ; nouvel appel d'offre publié par l'armée américaine
08/03/2020 | 19:00
https://ml-eu.globenewswire.com/Resource/Download/30f58138-2aaa-4dd6-be66-f860b8194f97
Saint Herblain (France), le 8 mars 2020 –Valneva SE (“Valneva” ou “le Groupe”), a annoncé aujourd’hui que l’agence de santé américaine FDA a approuvé une prolongation de la durée d’utilisation du vaccin contre l’encéphalite japonaise IXIARO® de 24 à 36 mois.
Le département américain de la défense (“DoD”) a par ailleurs publié un appel d’offres (RFP) pour la fourniture d’un vaccin contre l’encéphalite japonaise. Cet appel d’offre s’étend sur une période de trois ans et comprend une année ferme suivi de deux années optionnelles. En tant que fournisseur du seul vaccin contre l’encéphalite japonaise approuvé par la FDA, Valneva répondra à ce RFP avec diligence et, en cas de succès, s’attend à la signature d’un nouveau contrat au premier semestre 2020.
Franck Grimaud, Chief Business Officer de Valneva a indiqué, « Nous sommes ravis d’avoir reçu cette prolongation importante de la durée de vie d’IXIARO® aux Etats-Unis. Nous nous réjouissons de pouvoir continuer à travailler en étroite collaboration avec le département américain de la défense et de satisfaire leurs demandes. L’armée américaine utilise IXIARO® depuis dix ans et nous nous réjouissons de pouvoir aider à protéger les militaires, leurs familles, les retraités de l’armée et les employés du gouvernement américain contre cette maladie potentiellement mortelle. »
A propos de l’encéphalite japonaise
L'Encéphalite japonaise est une maladie infectieuse meurtrière qui sévit essentiellement en Asie. Environ 70 000 cas d’encéphalite japonaise seraient recensés chaque année en Asie, mais ce nombre serait sous-estimé au regard notamment des difficultés de comptabilisation dans les zones rurales. L’encéphalite japonaise est fatale chez environ 30% des personnes qui en présentent les symptômes et cause, chez la moitié des survivants, des dommages cérébraux irréversibles. La maladie est endémique en Asie du Sud-Est, une région dont le nombre d’habitants s’élève à 3 milliards. En 2005, une épidémie d’encéphalite japonaise au Népal et dans la région indienne d’Uttar Pradesh a tué plus de 1 200 enfants en un mois.
A propos de Valneva SE
Valneva est une société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses engendrant d’importants besoins médicaux. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l’encéphalite japonaise et DUKORAL®[1] dans la prévention du choléra et, dans certains pays, de la diarrhée causée par l’ETEC. Le groupe est également propriétaire d’un solide portefeuille de vaccins en développement dont le seul candidat vaccin en phase clinique contre la maladie de Lyme. Valneva compte environ 500 employés et exerce ses activités depuis l’Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d’information, consulter le site internet de la société www.valneva.com.
|
Répondre
|
Document : "Valneva 2020 J.P. Morgan Healthcare Conference Presentation" [PDF de 34 pages]
https://valneva.com/wp-content/uploads/2019/12/Valneva_Company_Presentation_JPM2020_Final.pdf
|
Répondre
|
''"Nous sommes confiants dans l’avancement de nos deux candidats vaccins."''
Interview de Franck Grimaud, Co-président et fondateur
17/02/2020
Issu de la fusion en 2013 du français Vivalis et de l’autrichien Intercell pour donner naissance à un acteur du vaccin intégré, Valneva s’attend à vivre une année 2020 extrêmement riche : résultats de Phase II et signature d’un accord de partenariat pour le vaccin contre la maladie de Lyme, entrée potentielle en Phase III du vaccin contre le chikungunya. Une levée de fonds de plus de 100M€ sur le Nasdaq début 2021 pourrait couronner le tout.
Franck Grimaud, avant d’en venir aux enjeux majeurs de 2020, pouvez-vous faire un point sur les deux vaccins actuellement commercialisés par Valneva, qui assurent sa profitabilité depuis 2018 ?
"La création en 2013 de Valneva avait pour objectif de donner naissance à un acteur intégré du vaccin, ce que nous sommes depuis 2015, année du rachat des droits de distribution de nos deux vaccins pour les voyageurs : Ixiaro, vaccin contre l’encéphalite japonaise, et Dukoral, vaccin contre le choléra. Cela nous a permis d’investir dans notre propre infrastructure de commercialisation et de plus que doubler nos ventes en quatre ans. Nous avons annoncé une prévision de CA 2019 de 125 à 130 M€, contre 103.5 M€ en 2018. Pour ce qui est des perspectives 2020 sur ces deux vaccins, Ixiario, qui n’a pas de concurrent, devrait bénéficier d’une nouvelle commande de la part de l’armée américaine au premier semestre et les ventes de Dukoral devraient résister à l’arrivée d’un concurrent européen compte tenu de l’indication plus large dont bénéficie notre produit au Canada où nous réalisons la majorité de nos ventes. Pour ce qui est de la profitabilité de notre portefeuille de produits, notre prévision de marge brute s’élève à 65% et notre prévision d’EBITDA 2019 à 5 à 10 M€ après comptabilisation en charges de 35 à 40 M€ de R&D. Ce budget R&D a servi essentiellement à financer le développement clinique de nos deux candidats vaccins, celui contre la maladie de Lyme, VLA 15, et celui contre le chikungunya, VLA 1553."
Concernant VLA 1553, la décision de la FDA est imminente. Quelles seront les enjeux en cas de passage en phase III ?
"Nous allons rencontrer ce 24 février la FDA pour une réunion de fin de Phase II de ce candidat vaccin. Nous saurons dans le mois qui suit si nous pouvons entrer directement en phase III, avec une approbation du vaccin attendue pour la fin 2022. Ce vaccin du voyageur s’adresse à un marché potentiel d’environ 400 M$ sur lequel nous visons au moins 50% de part de marché face à deux candidats concurrents ayant achevé leur phase II (Emergent BioSolutions Inc et Themis Bioscience GmbH NDLR). A noter que nous pensons avoir le seul candidat ne nécessitant qu’une seule injection. La production sera assurée par notre unité écossaise qui produit déjà Ixiaro, et la commercialisation par notre réseau déjà très présent sur les maladies du voyageur. La profitabilité de ce vaccin serait donc supérieure à celle de nos deux vaccins en portefeuille. Concernant les besoins de financement de cette phase III, que nous estimons à 60-80 M€, nous avons sécurisé un emprunt à 6 ans d’un montant de 60 à 85 M$ auprès de fonds américains à un taux situé dans la partie supérieure des taux à un chiffre."
Concernant VLA 15, quelles sont les prochaines échéances et les montants en jeu ?
"Les résultats de la phase II vont s’échelonner de juin à décembre 2020 pour les deux schémas de vaccination que nous avons lancé à l’été 2019. Un succès de cette phase nous permettrait de lancer la phase III. Compte tenu du nombre important de patients recrutés, 16 000, l’approbation ne pourrait intervenir avant 2024-2025. Concernant le financement des développements de phase III pour ce vaccin, compte tenu des besoins estimés à 300 M€, notre objectif est de signer un partenariat en 2020 puis de lever au moins 100 M€ à l’occasion d’une cotation sur le Nasdaq au premier semestre 2021. Le marché potentiel de ce vaccin en Europe et aux Etats-Unis pourrait dépasser le milliard de dollars, sachant qu’il n’y a pas à ce jour d’autre candidat vaccin en développement clinique contre cette maladie qui touche environ 300 000 personnes par an aux Etats-Unis et 200 000 en Europe, dont 7% en garderaient des séquelles durables. A noter que les cas identifiés sont en forte augmentation avec une multiplication par 3 sur 20 ans aux Etats-Unis."
Pourquoi avez-vous décidé de vous introduire sur le Nasdaq ?
"Le Nasdaq est aujourd’hui le marché le plus adapté aux financements de phase III nécessitant plusieurs centaines de millions d’euros de dépenses de développement clinique. La place de Paris vient de traverser deux années particulièrement difficiles sur les sciences de la vie et la profondeur du marché américain est bien supérieure. Ce projet d’introduction, qui a été précédé par la fin de notre cotation à Vienne et un premier placement privé aux Etats-Unis en septembre 2018, devrait nous permettre de lever plus de 100 M€. Une hausse de notre valorisation boursière d’ici la fin de l’année favorisée par un flux de nouvelles majeures faciliterait cette levée."
Actualité oblige : Valneva est-elle concernée d’une façon ou d’une autre par le Covid-19 ?
"Nous sommes bien évidemment concernés par l’épidémie de pneumonie virale qui sévit en Chine mais nous devons nous concentrer pour le moment sur nos deux candidats vaccins contre la maladie de Lyme et le chikungunya qui sont également deux maladies infectieuses extrêmement inquiétantes. Nous pourrions potentiellement à court terme devoir mener deux Phase III en parallèle, ce qui est déjà beaucoup pour une société de la taille de Valneva. Il y a, par ailleurs, déjà près d’une dizaine de vaccins en cours de développement pour traiter ou prévenir le coronavirus. Nous avons, bien évidemment, d’autres candidats vaccins dans le domaine anti-infectieux y compris du voyageur mais ils n’en sont pour l’instant qu’ au stade préclinique et ne mobilise qu’une infime partie de notre budget R&D."
|
Répondre
|
 0
0
On reprendrai bien une Tasse...what'else?
|
Répondre
|
Belle journée de hausse à 3,40 € et + 8,11% en clôture : la tasse haussière est bien validée.
(Voir graphe en précédent)
|
Répondre
|
ça continue : 3,35€ et + 6,52%
|
Répondre
|
 0
0
3.295 EUR +4.77 %
Ceci n'est ni une incitation à acheter, ni un conseil....etc etc..
|
Répondre
|
 0
0
https://www.zen-option.com/tasse-avec-anse/
Message complété le 04/02/2020 09:26:15 par son auteur.
Pour le 9/01/2020 j'ai retrouvé l'info à l'origine de la flambée:
"Valneva : ouverture d'une structure commerciale en France", qui s'est traduit par un bond de 17% dans la journée.
Message complété le 04/02/2020 09:27:38 par son auteur.
Évidemment recommandations d'usage: ceci n'est ni un conseil, ni une incitation a l'achat...etc...etc
|
Répondre
|
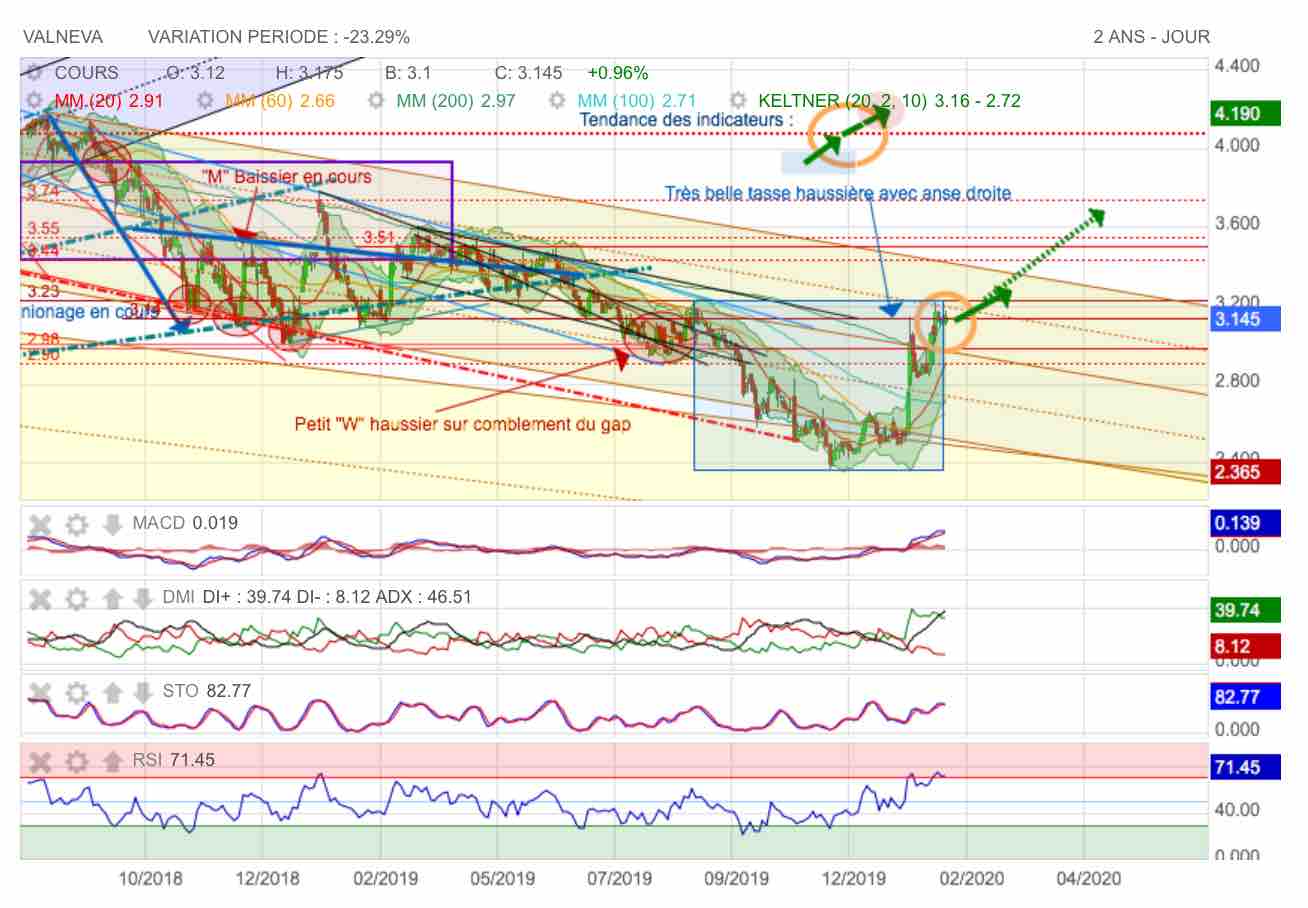
Sortie haussière à venir d'une très belle tasse avec anse en direction de 3,60 euros
ça se passe dans le rectangle bleue : difficile de la louper, celle-là.
On notera que la MM 20 rouge remonter en toute urgence à l'assaut de la MM 200 verte après embrochée les MM 60 orange et MM 100 bleue en retournement haussier.
Tous les indicateurs sont cabrés sous la pression en surachat du RSI. Attention à la publication annuelle 2019, ça devrait décoller si vous avez bien bouclés votre ceinture...
.
|
Répondre
|
 0
0
merci Gars d'ain pour ces infos, elles sont publique depuis aujourd'hui.
Constat: le 9/01 flambée de 16%....?? ceci sans raison, connue du public...
Message complété le 04/02/2020 08:38:10 par son auteur.
publiques
|
Répondre
|
Valneva: le département américain de la Défense exerce l’option du contrat IXIARO® portant sa valeur à $70 millions
Communiqué de presse [PDF] • January 14, 2020
https://valneva.com/wp-content/uploads/2020/01/2020_01_14_VLA_IXIARO_DoD_Option_PR_FR.pdf
__________________________________________________________________________________________
Saint Herblain (France), 14 janvier 2020 – Valneva SE (“Valneva” ou “le Groupe”), a annoncé aujourd’hui que le Département américain de la Défense (DoD) avait exercé une option pour acheter 80 000 doses supplémentaires du vaccin contre l’encéphalite japonaise, IXIARO®. ®. Cette option porte la valeur du contrat signé en janvier 2019 avec le Département américain de la Défense à $70 millions. [1] L’approvisionnement lié à cette option va débuter très prochainement.
Valneva prévoit, par ailleurs, de signer un nouveau contrat avec le Département de la Défense durant le premier semestre de cette année.
Franck Grimaud, Chief Business Officer de Valneva a indiqué, « Nous remercions le Département de la défense américain pour leur confiance renouvelée qui nous permet de les aider à protéger le personnel militaire et leur famille contre l’encéphalite japonaise. Nous nous réjouissons de pouvoir poursuivre notre collaboration avec ce Département. »
IXIARO® est le seul vaccin contre l’encéphalite japonaise approuvé par l’autorité de santé américaine, la FDA. Le vaccin a été développé dans le cadre d’un accord de collaboration de recherche et développement avec le Centre de recherche de l’armée américaine « Walter Reed Army Institute of Research ». Valneva assure le marketing et la distribution d’IXIARO® ® à l’armée américaine et sur le marché privé américain.
A propos de Valneva SE
Valneva est une société de vaccins spécialisée dans la prévention des maladies engendrant des besoins médicaux importants et non satisfaits. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®.® contre l’encéphalite japonaise et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par l’ETEC . Le groupe est également propriétaire d’un solide portefeuille de vaccins en développement dont le seul candidat vaccin en phase clinique contre la maladie de Lyme. Valneva compte environ 490 employés et exerce ses activités depuis l’Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d’information, consulter le site internet de la société www.valneva.com.
Contacts Valneva investisseurs et les médias
Laetitia Bachelot-Fontaine
Global Head of Investor Relations &
Corporate Communications
M +33 (0) 6 4516 7099
investors@valneva.com
Teresa Pinzolits
Corporate Communications Specialist
T +43 (0) 1 20 620 1116
communications@valneva.com
[1] Valneva signe un nouveau contrat de $59 millions avec le gouvernement américain pour la fourniture de son vaccin IXIARO®® '
|
Répondre
|
Décidément que du bon ! Le projet d'introduction au Nasdaq devrait booster le titre qui mérite vraiment mieux quand on voit des biotech nettement mieux cotées alors qu'elles ne réalisent aucun CA récurrent. Les prévisions pour 2020 sont d'ailleurs excellentes...
Valneva : annonce un accord de financement de $85 millions avec deux fonds US, Deerfield et Orbimed, spécialistes du secteur de la santé
03/02/2020 | 22:30
Le Groupe confirme par ailleurs son intention de s’introduire sur le Nasdaq à moyen terme afin de co-financer la dernière phase de développement de son vaccin contre la maladie de Lyme
L’accord inclut un emprunt de $60 millions à taux fixe et la possibilité de procéder à des tirages supplémentaires jusqu’à $25 millions au cours des douze prochains mois
Valneva prévoit d’utiliser les fonds pour poursuivre l’avancée de ses deux principaux programmes cliniques contre la maladie de Lyme et le chikungunya ainsi que pour rembourser un emprunt existant
Saint-Herblain (France), 3 février 2020 – Valneva SE (“Valneva” ou “le Groupe”) a annoncé aujourd’hui la signature d’un accord de financement avec deux fonds gérés par deux prestigieuses sociétés d’investissement américaines spécialistes du secteur de la santé, Deerfield Management Company et OrbiMed. Les deux sociétés ont octroyé ce financement afin de soutenir la stratégie à long terme de Valneva.
L’accord inclut un emprunt à taux fixe de $60 millions (à un taux situé dans la partie supérieure des taux à un chiffre) ainsi que la possibilité de tirer jusqu’à $25 millions supplémentaires, aux mêmes conditions, au cours des douze prochains mois. Le remboursement de l’emprunt débutera dans trois ans et le prêt arrivera à maturité dans six ans. Les fonds seront alloués au remboursement d’un prêt précédemment octroyé par la Banque Européenne d’investissement (BEI), et, très rapidement, à la poursuite du développement des deux principaux programmes cliniques du Groupe contre la maladie de Lyme et le chikungunya. La réalisation de l'opération est soumise à la réalisation de conditions suspensives, notamment à la constitution de plusieurs nantissements et sûretés sur les principaux actifs de Valneva et de ses filiales.
David Lawrence, Directeur financier de Valneva a indiqué, “Nous sommes ravis d’avoir signé ce nouvel accord de financement avec ces deux grands partenaires car il nous permet de renforcer notre trésorerie pour le développement de nos candidats vaccins sans diluer nos actionnaires actuels. Nous apprécions fortement le soutien renouvelé de Deerfield et OrbiMed dans nos stratégies opérationnelles et de développement. Nous souhaitons également remercier la Banque Européenne d’Investissement pour son excellent soutien durant ces dernières années”.
Valneva confirme par ailleurs son intention, sous réserve de l’approbation des actionnaires du Groupe, de s’introduire sur le Nasdaq afin de pouvoir potentiellement co-financer le développement clinique avancé de son programme contre la maladie de Lyme. Le Groupe a achevé le recrutement des patients de phase 2 fin septembre et prévoit de publier des premiers résultats (sur le critère d’évaluation principal) mi 2020.
Guggenheim Securities a agi en tant que Conseil financier et Dechert LLP en tant que Conseil juridique pour cette opération.
A propos de Deerfield
Deerfield est une société de financement engagée dans le développement des soins de santé par l'investissement, l'information et la philanthropie.
A propos d’OrbiMed
OrbiMed est une société d'investissement spécialisée dans le secteur de la santé disposant de $13 milliards d'actifs sous gestion. OrbiMed investit dans le monde entier dans le secteur de la santé, de la start-up aux grandes sociétés multinationales, au travers de fonds d’investissements privés, de fonds d’investissements publics et de fonds de redevances/crédit. OrbiMed dispose de bureaux à New York, San Francisco, Shanghai, Hong Kong, Mumbai et Herzliya. OrbiMed cherche à être un fournisseur de capitaux de choix, en apportant des solutions de financement sur mesure ainsi que les ressources et le soutien d'une équipe mondiale afin de contribuer à construire des entreprises de santé de premier plan.
A propos de Valneva SE
Valneva est une société de vaccins spécialisée dans la prévention des maladies engendrant des besoins médicaux importants et non satisfaits. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO® contre l’encéphalite japonaise et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par l’ETEC1. Le groupe est également propriétaire d’un solide portefeuille de vaccins en développement dont le seul candidat vaccin en phase clinique contre la maladie de Lyme. Valneva compte près de 500 employés et exerce ses activités depuis l’Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d’information, consulter le site internet de la société www.valneva.com.
Message complété le 04/02/2020 08:23:02 par son auteur.
Le lien PDF
https://valneva.com/wp-content/uploads/2020/02/2020_02_03_VLA_Deerfield-Orbi_PR_FR.pdf
|
Répondre
|
Calendrier annuel des publications et des évènements pour Valneva en 2020
• 9 & 10 janvier 2020 : Oddo BHF Forum
• 12 au 16 janvier 2020 : J.P. Morgan Healthcare Conférence
• 28 Janvier 2020 : Biomed Event by Invest Securities
• 27 Février 2020 : Résultats annuels 2019 non audités
• 31 Mars 2020 : Résultats annuels 2019 audits
• 7 au 9 Avril 2020 : World Vaccine Congress Washington
• 7 mai 2020 : Résultats 1er Trimestre 2020
• 8 au 11 juin 2020 : BIO International Convention
• 17 juin 2020 : Assemblée Générale
• 4 Août 2020 : Résultats semestriels 2020
• 29 Octobre 2020 : Résultats du 3ème trimestre 2019 et publication à 9 mois
Le lien de l'agenda en cours
https://valneva.com/investors/calendar/?lang=fr
___________________________________________
NB : The financial calendar is for indicative purposes only and the Group could change its publication dates should it deem it necessary.
|
Répondre
|
