Valneva: contrôle direct des ventes d'Ixiaro aux Etats-Unis. - Page 6
Cours temps réel: 4,218 3,48%| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
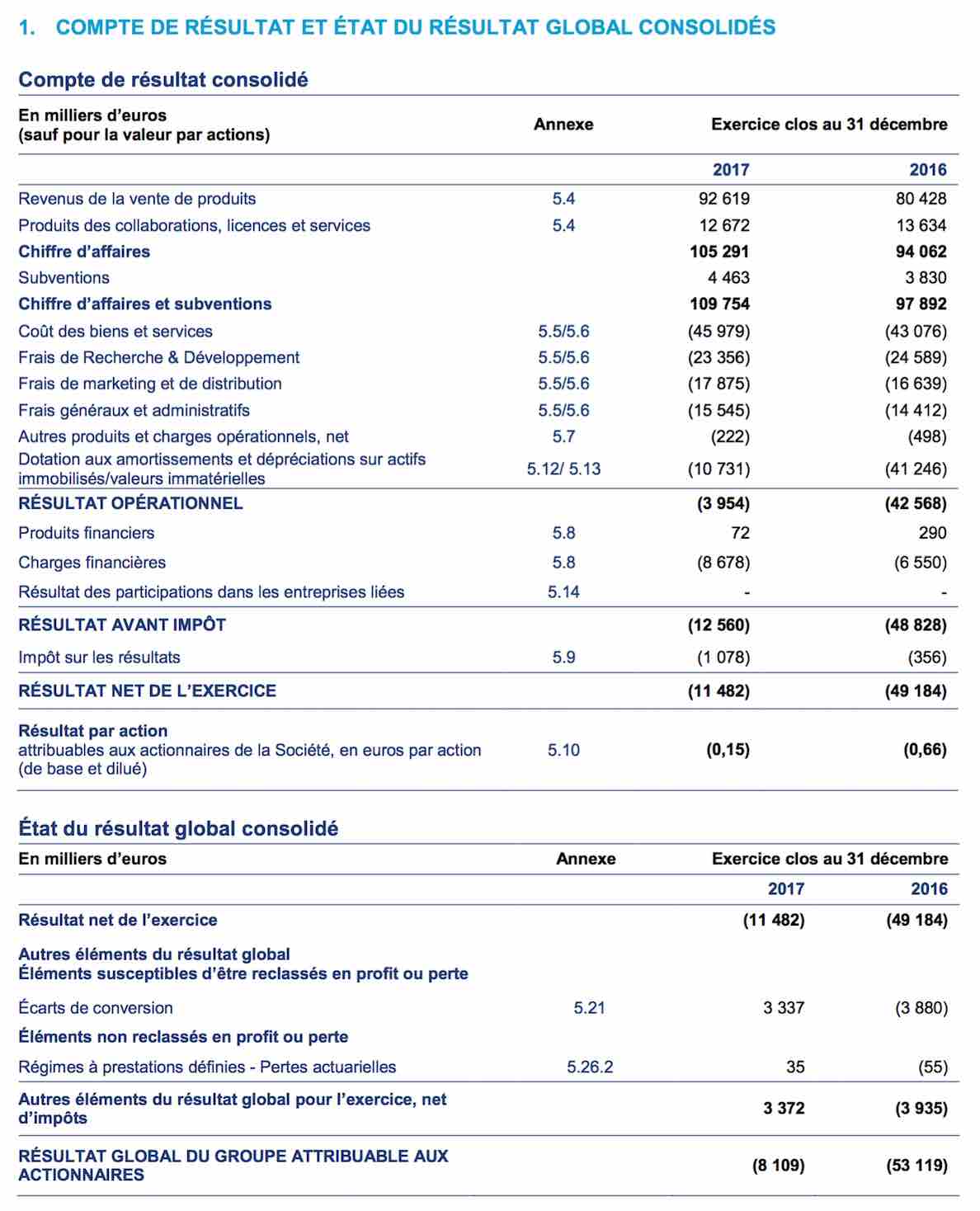
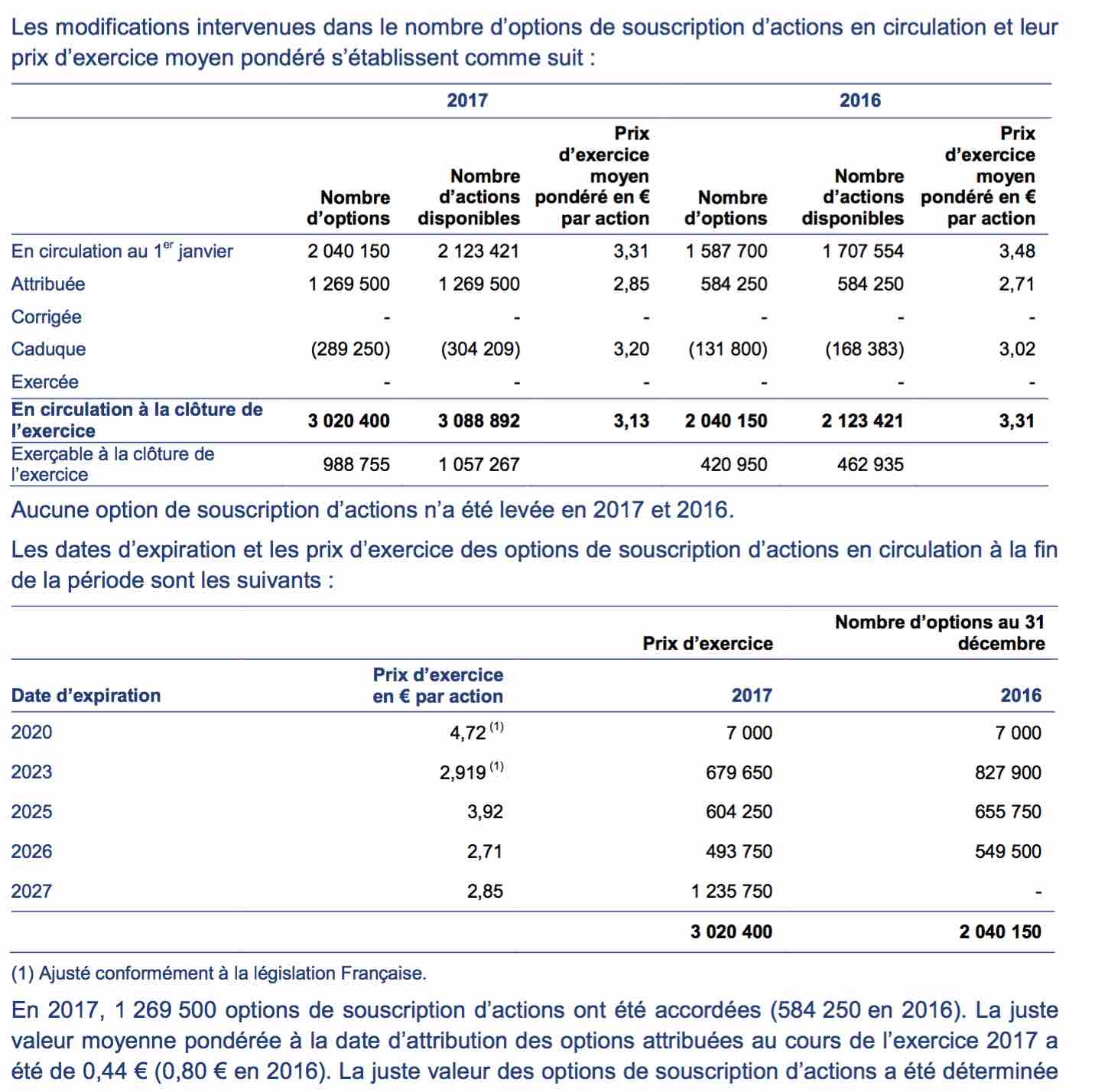
Extrait de la publication annuelle 2017 :Comptes Consolidés IFRS 2017 page 4 :
.
|
Répondre
|
Vous noterez que celles expirant en 2020 sont à un prix d'exercice de 4,72 euros.
Soit au cous de ce jour à 3,72 euros, un potentiel de +28 %, soit à minima +8 % par an pour y arriver...
|
Répondre
|
Concernant "Clostridium Difficile"
Extrait de la publication annuelle 2017 :
Comptes Consolidés IFRS 2017 page 28 :
"En 2017, l’actif incorporel Clostridium Difficile (3,6 M€) a été entièrement déprécié du fait de son abandon par GSK et des tentatives infructueuses pour trouver d’autres partenaires de co- développement. En 2016, une perte de valeur de 34,1 millions d’euros a été comptabilisée suite aux résultats négatifs des études de phases II/III sur le vaccin candidat contre Pseudomonas et à l’arrêt du programme."
http://www.valneva.com/fr/investisseurs-media/rapports-financiers
Message complété le 22/03/2018 15:29:14 par son auteur.
" Les partenaires potentiels hésitent quant au niveau d’investissement requis pour financer un essai clinique de phase III sur Clostridium difficile. Face à ce retour d’expérience, Valneva a revu son approche de développement et de partenariat, ce qui a donné lieu à une révision du modèle économique existant au troisième trimestre 2017 et s’est traduit par une réduction des flux de trésorerie futurs et une dépréciation de 3,6 M€. "
|
Répondre
|
Extrait de la publication annuelle 2017 :
Comptes Consolidés IFRS 2017 page 24 :
5.9.2. Impôt différé
Au 31 Décembre 2017, les impôts différés actifs d’un montant de 101,9 M€ (113,4 M€ en 2016) ne sont pas comptabilisés, dans la mesure où il est peu probable de disposer de suffisamment de profits fiscaux futurs pour imputer une partie de ces pertes fiscales reportées.
Au 31 Décembre 2017, le Groupe a un report déficitaire de 445,2 M€ (434,3 M€ en 2016), dont 122,7 M€ proviennent de Valneva SE (105,5 M€ en 2016), 318,1 M€ proviennent de Valneva Austria GmbH (324,7 M€ en 2016), 2,4 M€ proviennent de Intercell USA, Inc. (3,6 M€ en 2016), et 2,1 M€ proviennent de Valneva Sweden AB (481 K€ en 2016).Les reports déficitaires n’ont pas de date d’expiration en France, en Autriche, et en Suède alors que les pertes fiscales des entités basées aux États-Unis commenceront à expirer en 2033 si elles ne sont pas utilisées.
Message complété le 22/03/2018 15:25:09 par son auteur.
Le résultat net 2017 équivaut à -0,15 euros par action en 2017 contre -0,66 en 2016.
|
Répondre
|
Message complété le 22/03/2018 13:25:17 par son auteur.
En fait il semblerait que ce soit sur des immobilisations incorporelles (matériel)... à suivre donc mais ils n'en parlent même plus dans leur présentation
|
Répondre
|
|
Répondre
|
|
Répondre
|
.
|
Répondre
|
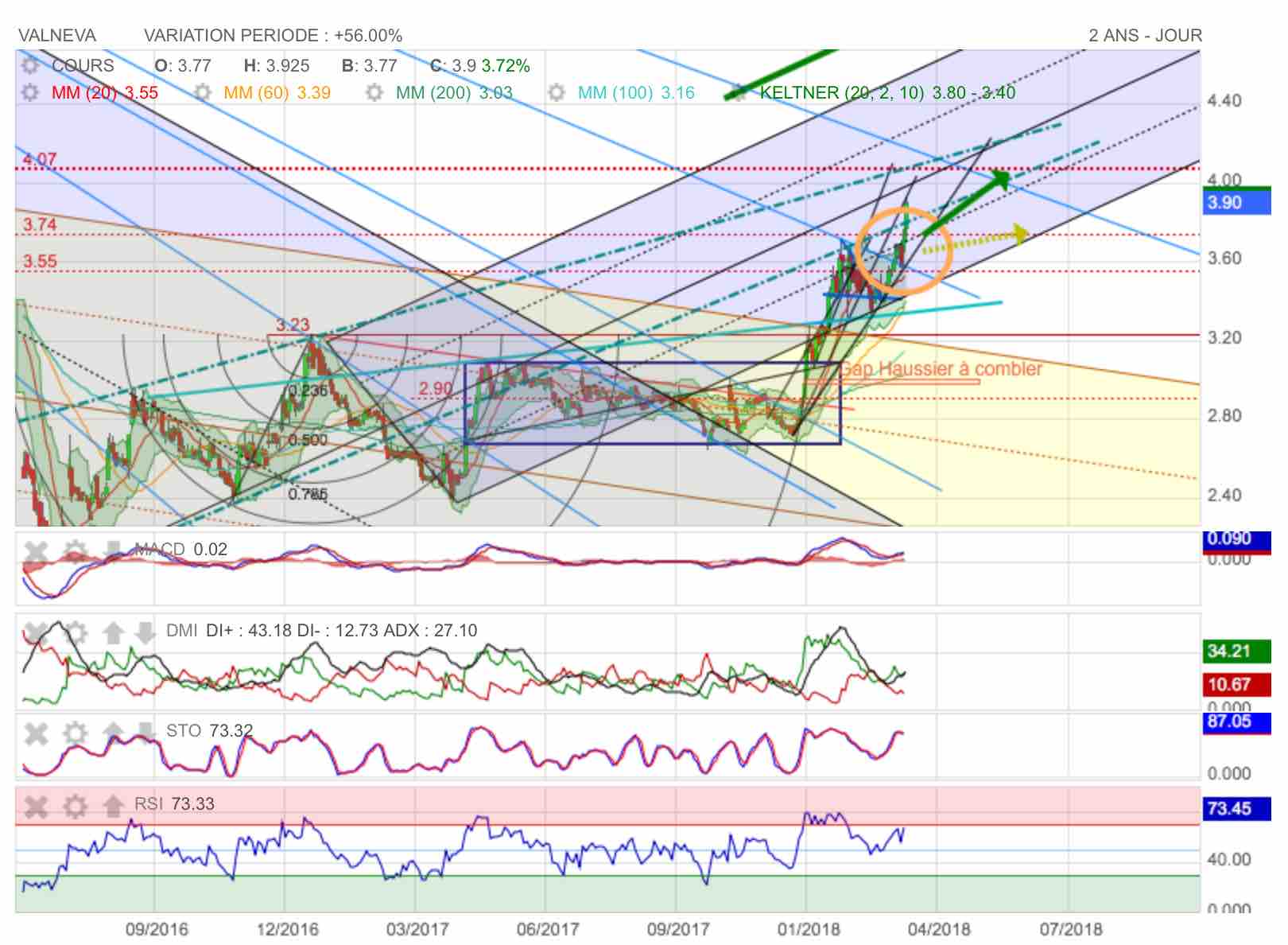
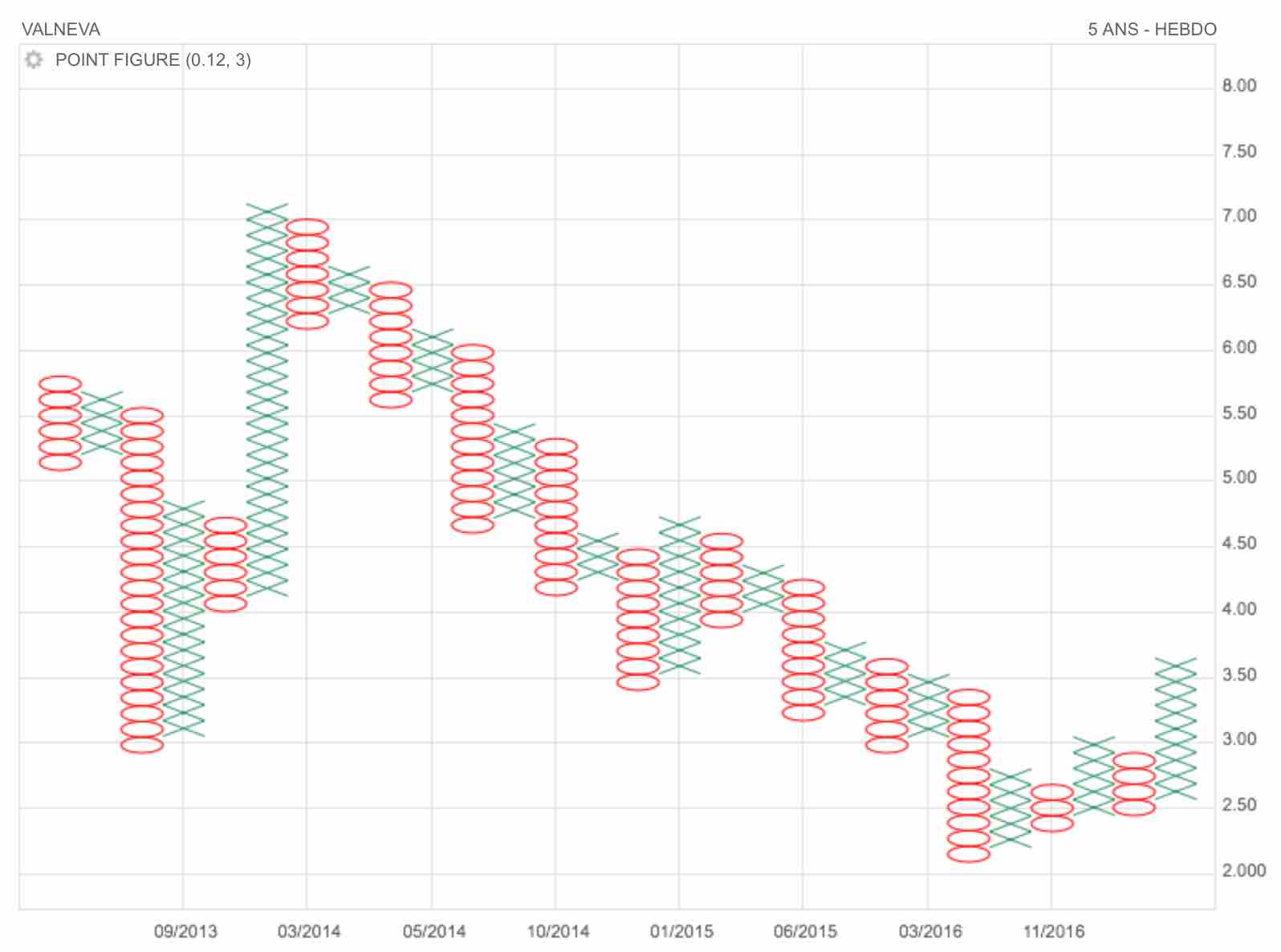
Vue de la zone de changement d'aiguillage de fourchette d'andrews.
Graphe de Moyen terme : N°3 !
(Voir détail des graphe 1 et 2 en posts précédents)
.
|
Répondre
|
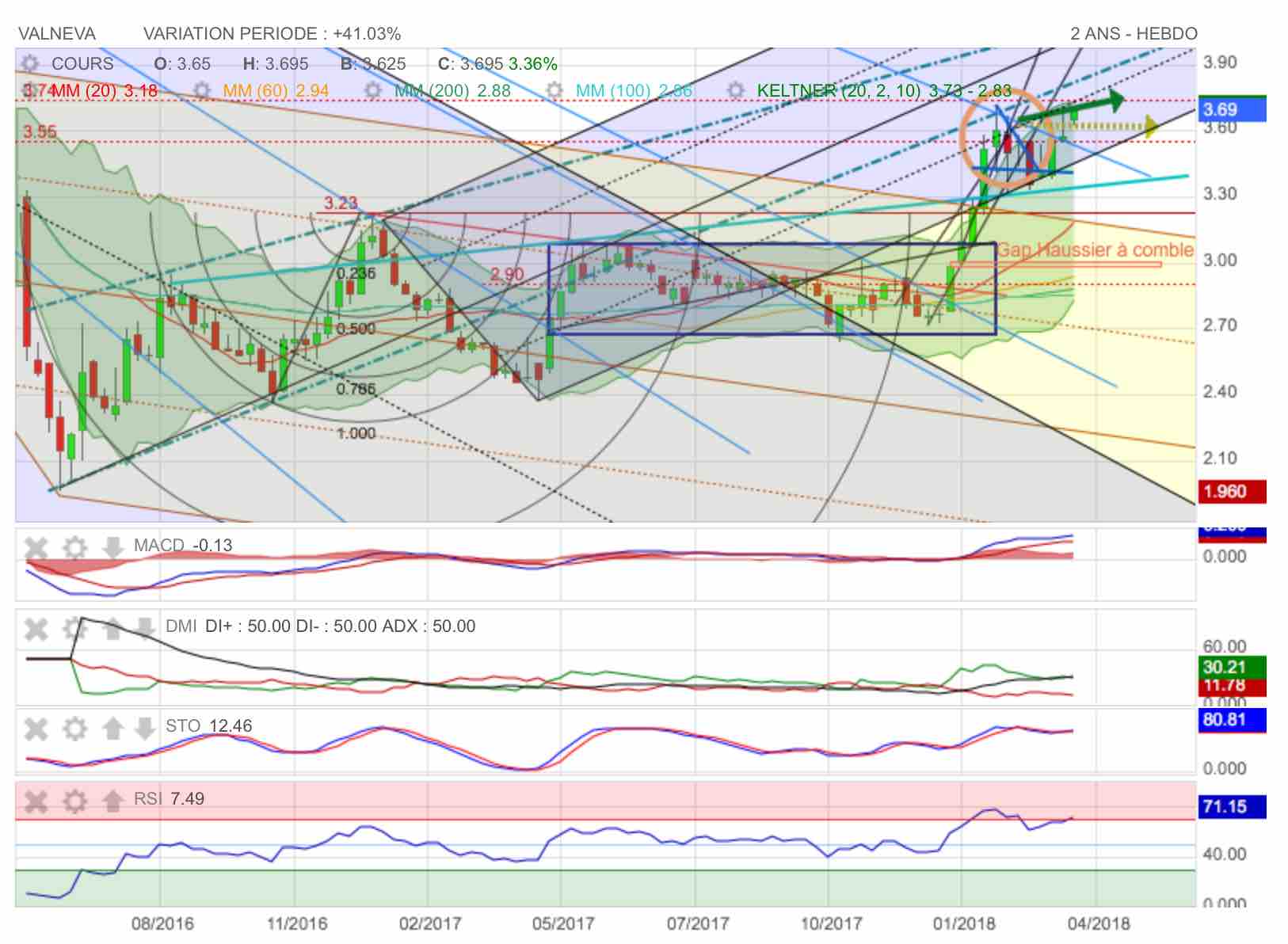
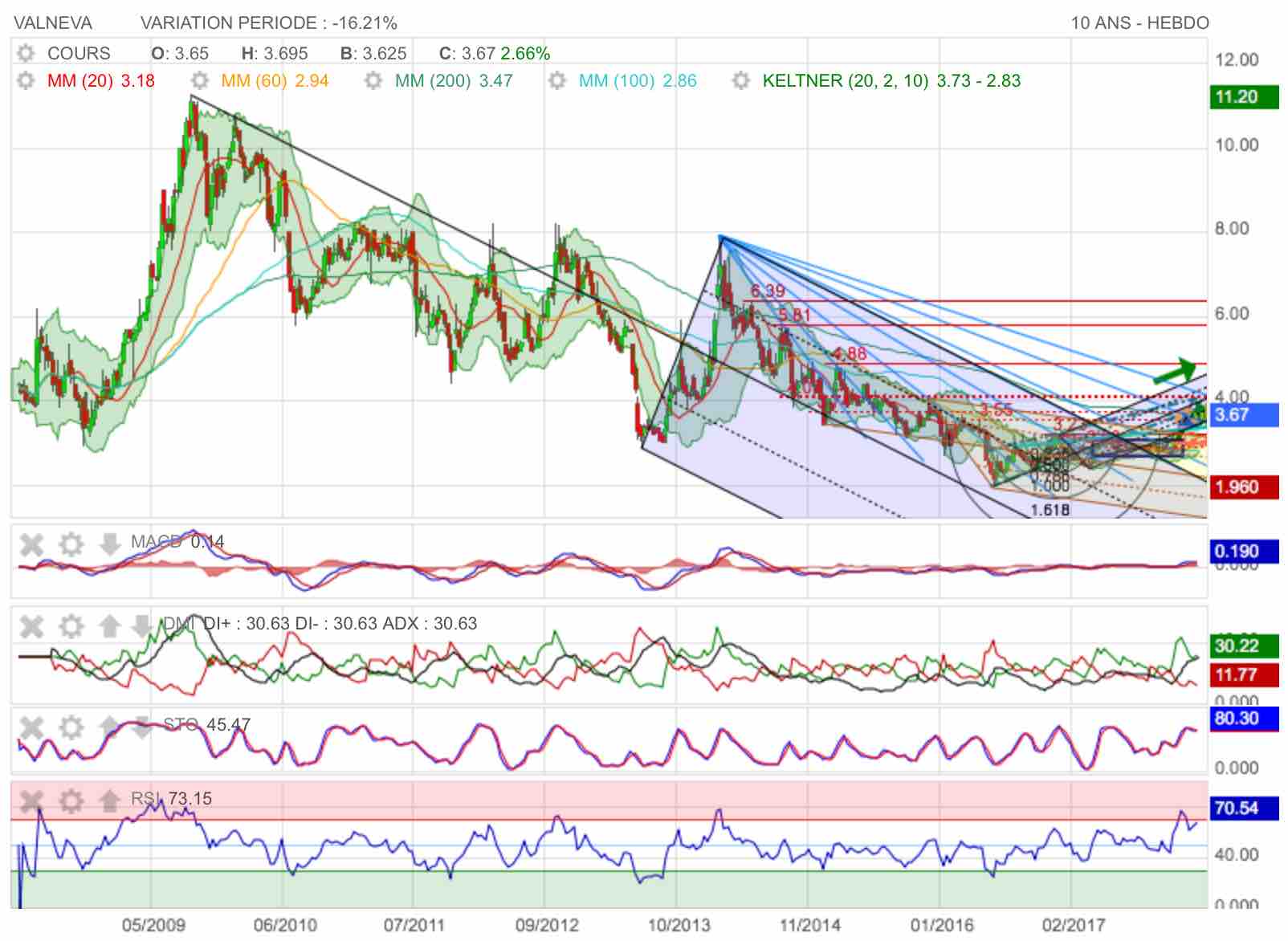
La recovery est bien en marche...
La recovery a débuté en mars 2016 comme le montre cette sortie haussière de fanion
Graphe de long terme : N°1
Message complété le 19/03/2018 10:51:46 par son auteur.
Lire : Graphe de long terme : N°2 !
.
|
Répondre
|
comme le montre ce graphe de long terme en hebdo, on est nettement sorti de la première grande fourchette baissière d'andrews et on a également quitté la fourchette N°2 de latéralisation en marron et jaune.
On notera d'autre part le râteau haussier bleu en bonne voie : prochaine étape, le franchissement des 4,00 et à moyen terme un retour sur 7,90...
Graphe de long terme : N°1
.
|
Répondre
|
19/03/2018 | 07:01
Communiqué de presse
Valneva publie des résultats intermédiaires de Phase I positifs pour son candidat vaccin contre la maladie de Lyme VLA15
• Critère d'évaluation principal de l'étude de Phase I (VLA15-101) atteint
• Aucun problème de sécurité associé à VLA15 dans tous les groupes vaccinés
• Immunogénicité encourageante du vaccin VLA15
• VLA15 est immunogène dans toutes les doses et formulations testées
• Bonne réponse des anticorps IgG spécifiques de l'OspA contre tous les sérotypes d'OspA
__________________________
Lyon (France), 19 mars 2018 - Valneva SE ("Valneva" ou "le Groupe"), société de biotechnologie dédiée au développement, à la production et à la commercialisation de vaccins innovants, annonce aujourd'hui des résultats intermédiaires positifs de Phase I pour son candidat vaccin contre la maladie de Lyme VLA15.
L'objectif principal de l'étude de Phase I, VLA15-101, était d'évaluer le profil d'innocuité et de tolérance du candidat vaccin dans différentes doses et formulations. L'immunogénicité, mesurée en déterminant les anticorps IgG contre les six principaux sérotypes de la borréliose de Lyme présents aux Etats-Unis (ST1) et en Europe (ST1 à ST6) et contenus dans le vaccin, a également était mesurée dans différents groupes de vaccination et différentes formulations à différents points dans le temps.
Cette analyse intermédiaire des critères principal et secondaire de l'étude portait sur les données d'innocuité et d'immunogénicité recueillis jusqu'au Jour 84 de l'étude (3ème mois).
L'étude a atteint son critère principal: le candidat vaccin a montré un profil d'innocuité favorable. Très peu d'effets indésirables sévères et aucun problème de sécurité ont été constatés chez les groupes vaccinés.
Aucune différence dans le profil d'innocuité n'a été constatée entre les groupes vaccinés avec une formulation du vaccin contenant un adjuvant et ceux vaccinés avec une formulation sans adjuvant.
Le profil d'innocuité obtenu dans toutes les doses et formulations testées est considéré comme comparable à d'autres vaccins recombinants lipidiques existants ou d'autres formulations de vaccins à base de lipides existantes, permettant ainsi la poursuite du développement clinique pour toutes les doses et formulations de VLA15.
VLA15 a, par ailleurs, démontré être immunogène dans toutes les doses et formulations testées. Une réponse des anticorps IgG spécifiques de l'OspA a été constatée dans tous les groupes vaccinés et contre tous les sérotypes d'OspA, ainsi qu'une forte différence de réponse immunitaire entre les groupes vaccinés avec les plus fortes et faibles doses. VLA15 a démontré une meilleure immunogénicité dans les groupes vaccinés avec une formulation du vaccin contenant un adjuvant comparés aux groupes vaccinés avec une formulation sans adjuvant. Pour les six sérotypes de l'OspA, les niveaux d'IgG étaient par ailleurs plus élevés après trois immunisations (Jour 84) qu'après deux (Jour 56).
Le taux de séroconversion (SCR) pour le groupe ayant reçu la plus forte dose du vaccin avec adjuvant, dose pressentie pour la suite du développement clinique du vaccin, se situait entre 71,4% et 96,4% pour l'ensemble des sérotypes de l'OspA.
Wolfgang Bender, MD, PhD, Directeur Médical de Valneva a indiqué, « Nous sommes ravis de pouvoir annoncer le succès du premier essai chez l'homme de notre vaccin contre la maladie de Lyme, une infection grave qui touche un nombre grandissant de personnes chaque année. Nous avons hâte de pouvoir offrir une prévention efficace contre une maladie qui est trop souvent sous-diagnostiquée, laissant ainsi de nombreuses personnes infectées par la maladie sans aucun traitement ou des traitements inadaptés, et générant par ailleurs d'importants coûts en termes de Santé publique. »
Valneva s'attache aujourd'hui à faire entrer le plus rapidement possible son vaccin contre la maladie de Lyme en Phase II, une fois les échanges requis avec les autorités compétentes terminés. Le lancement de la Phase II est actuellement prévu au second semestre 2018.
Cette phase clinique devrait être menée dans des régions où la maladie de Lyme est endémique et devrait, par ailleurs, inclure des personnes ayant déjà été infectées avec la Borrelia burgdorferi, bactérie à l'origine de la maladie de Lyme. Une optimisation du dosage du vaccin va également être envisagée.
A propos de l'étude clinique de Phase I VLA15-101
Cette étude de Phase I, à simple aveugle, partiellement randomisé, à dose croissante, est le premier essai clinique chez l'homme visant à évaluer l'innocuité, la tolérance et l'immunogenicité du candidat vaccin de Valneva VLA15. 179 volontaires sains âgés de moins de 40 ans et n'ayant jamais été en contact avec la bactérie Borrelia burgdorferi ont été recrutés pour l'étude. Ces volontaires ont été divisés en six groupes de vaccinations afin de recevoir l'une des trois doses du vaccin dans une formulation avec ou sans adjuvant. Les volontaires de l'étude ont été vaccinés à trois reprises à un mois d'intervalle (Jour 0-28-56). L'analyse intermédiaire des critères principal et secondaire de l'étude comprenait des données d'innocuité et d'immunogénicité recueillis jusqu'au Jour 84 de l'étude (3ème mois). Les données finales d'innocuité et d'immunogénicité, qui incluront un suivi d'un an des personnes vaccinées, sont attendues début 2019.
Des informations complémentaires, dont notamment une description détaillée du protocole de l'étude, les critères d'éligibilité, ainsi que les sites où l'étude a été menée, son disponibles sur ClinicalTrials.gov en utilisant l'identifiant NCT03010228.
A propos de la maladie de Lyme
La maladie de Lyme est une infection systémique causée par la bactérie Borrelia transmise à l'homme par les tiques Ixodes[1]. Selon l'organisme américain de contrôle et de prévention des maladies (CDC), environ 400 000 américains[2] sont diagnostiqués chaque année et au moins 200 000 cas seraient également recensés chaque année en Europe[3].
Les premiers symptômes de la maladie (éruption érythémateuse ou d'autres symptômes moins spécifiques de la maladie tels que fatigue, fièvre, maux de tête, rigidité de la nuque, arthralgie ou myalgie) sont souvent ignorés ou mal interprétés. En cas de traitement tardif ou inadéquat de la maladie, l'infection peut conduire à de sévères complications articulaires (arthrite), cardiaques (cardite) ou du système nerveux central.
Le besoin médical pour un vaccin contre la maladie de Lyme ne cesse d'augmenter alors que la maladie continue à s'étendre géographiquement[4].
A propos de VLA15
Le candidat vaccin de Valneva, VLA15, est actuellement le seul programme clinique actif contre la maladie de Lyme. Ce programme a reçu le statut de "Fast track" de l'autorité de santé américaine, FDA, en juillet 2017[5].
VLA15 est un nouveau vaccin multivalent à sous-unités de protéines ciblant la surface externe de la protéine A (OspA) de la Borrelia. L'indication ciblée par le candidat vaccin de Valneva est une immunisation prophylactique active contre la maladie de Lyme chez les personnes de plus de deux ans, avec pour objectif d'offrir une protection contre la majorité des sources de Borrelia pathogènes pour l'homme.
VLA15 est conçu pour offrir une protection contre la maladie de Lyme en augmentant le niveau d'anticorps empêchant la bactérie Borrelia de migrer de la tique à l'homme après une morsure. Le profil d'innocuité devrait être semblable à celui d'autres vaccins qui utilisent la même technologie et qui ont déjà été approuvés pour une immunisation active chez l'adulte et l'enfant.
La population ciblée par la vaccin inclut les individus à risques vivant dans les zones endémiques, les personnes ayant prévu de voyager dans les zones endémiques et de pratiquer des activités de plein air ainsi que les personnes ayant déjà été touchées par la maladie (puisqu'une infection par Borrelia ne confère pas d'immunité protectrice contre toutes les souches de Borrélia pathogènes pour l'homme).
La vaccination par OspA a déjà prouvé son efficacité dans les années 90 et les données précliniques du vaccin VLA15 ont révélé que ce candidat vaccin offrait une protection contre la majorité des souches de Borrelia pathogènes pour l'homme[6].
Le marché mondial pour un vaccin contre la maladie de Lyme est actuellement estimé à entre €700 et €800 millions par an.
A propos de Valneva SE
Valneva est une société de biotechnologie spécialisée dans le développement, la production et la commercialisation de vaccins innovants. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l'encéphalite japonaise, et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par L'ETEC. Le groupe est également propriétaire de vaccins en développement dont le seul candidat vaccin contre la maladie de Lyme. Valneva compte plus de 450 employés et exerce ses activités depuis l'Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d'information, consulter le site internet de la société www.valneva.com.
Valneva Investor and Media Contacts
Laetitia Bachelot Fontaine
Global Head of Investor Relations &
Corporate Communications
M +33 (0)6 4516 7099
[email protected]
Teresa Pinzolits
Corporate Communications Specialist
T +43 1206 201 116
[email protected]
Information importante
Ce communiqué de presse contient certaines déclarations prospectives relatives à l'activité de Valneva y compris en ce qui concerne l'avancée, le calendrier et l'achèvement de projets de recherche ou de développement et d'essais cliniques de candidats produits, la capacité de fabriquer et commercialiser des candidats produits et leur acceptation par le marché, la capacité à protéger la propriété intellectuelle et à travailler sans enfreindre les droits de propriété intellectuelle de tiers, les estimations de rendement et les estimations futures concernant les pertes d'exploitation anticipées, les revenus futurs, les besoins en capitaux et autres besoins additionnels de financement. En outre, même si les résultats réels ou le développement de Valneva sont conformes aux énoncés prospectifs contenus dans ce communiqué de presse, ces résultats ou évolutions de Valneva peuvent ne pas être représentatifs du futur. Dans certains cas, vous pouvez identifier les énoncés prospectifs par des termes comme «pourrait», «devrait», «s'attend à», « anticipe », « croit », « a l'intention », « estime », « vise », « cible » ou des mots similaires. Ces énoncés prospectifs sont basés en grande partie sur les attentes actuelles de Valneva à la date du présent communiqué et sont assujettis à un certain nombre de risques et incertitudes connus et inconnus ainsi qu'à d'autres facteurs qui pourraient faire que les résultats réels, le rendement ou les réalisations réels diffèrent considérablement des résultats futurs, des performances ou réalisations futurs, exprimés ou sous-entendus par ces énoncés prospectifs. En particulier, les attentes de Valneva pourraient être affectées par, entre autres, des incertitudes liées au développement et à la fabrication de vaccins, à des résultats d'essais cliniques inattendus, des actions réglementaires inattendues ou des retards, à la concurrence en général, aux fluctuations monétaires, à l'impact de la crise mondiale et européenne du crédit, et à la capacité à obtenir ou à conserver un brevet ou toute autre protection de propriété intellectuelle. Compte tenu de ces risques et incertitudes, il ne peut y avoir aucune assurance que les énoncés prospectifs formulés dans le présent communiqué seront effectivement réalisés. Valneva fournit les informations contenues dans ce communiqué de presse à la date de celui-ci et décline toute intention ou obligation de mettre à jour ou de réviser publiquement tout énoncé prospectif, que ce soit en raison de nouvelles informations, d'événements futurs ou pour d'autres raisons.
[1] Stanek et al. 2012, The Lancet 379:461-473
[2] As estimated by the CDC based on reported cases in 2015
[3] Estimated from available national data. Number largely underestimated based on WHO Europe Lyme Report as case reporting is
highly inconsistent in Europe and many LB infections go undiagnosed; ECDC tick-borne-diseases-meeting-report
[4]New Scientist, Lyme disease is set to explode and we still don't have a vaccine; March 29, 2017
https://www.newscientist.com/article/mg23431195-800-lyme-disease-is-set-to-explode-and-you-cant-protect-yourself/
[5] http://www.valneva.com/en/investors-media/news/2018;
[6] http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0113294.2018_03_19_VLA15 Phase 1 Results_FR
|
Répondre
|
|
Répondre
|
Communiqué de presse : 27/02/18 07:53
Valneva et Emergent BioSolutions annoncent l'initiation d'un essai clinique de Phase I aux Etats-Unis pour évaluer l'innocuité et l'immunogénicité de VLA1601, leur candidat vaccin contre le virus Zika, étude contrôlée par placebo.
Deux dosages différents de VLA1601 seront étudiés sur environ 65 adultes sains dans un seul centre clinique selon deux schémas de vaccination distincts. Les premières données de l'essai devraient être disponibles fin 2018 ou début 2019.
Les parties partageront l'intégralité des coûts de développement jusqu'à l'obtention des données de Phase I aux Etats-Unis. Valneva sera responsable de l'exécution du programme jusqu'à la clôture de l'essai de Phase I par le biais d'une structure de gouvernance conjointe.
|
Répondre
|
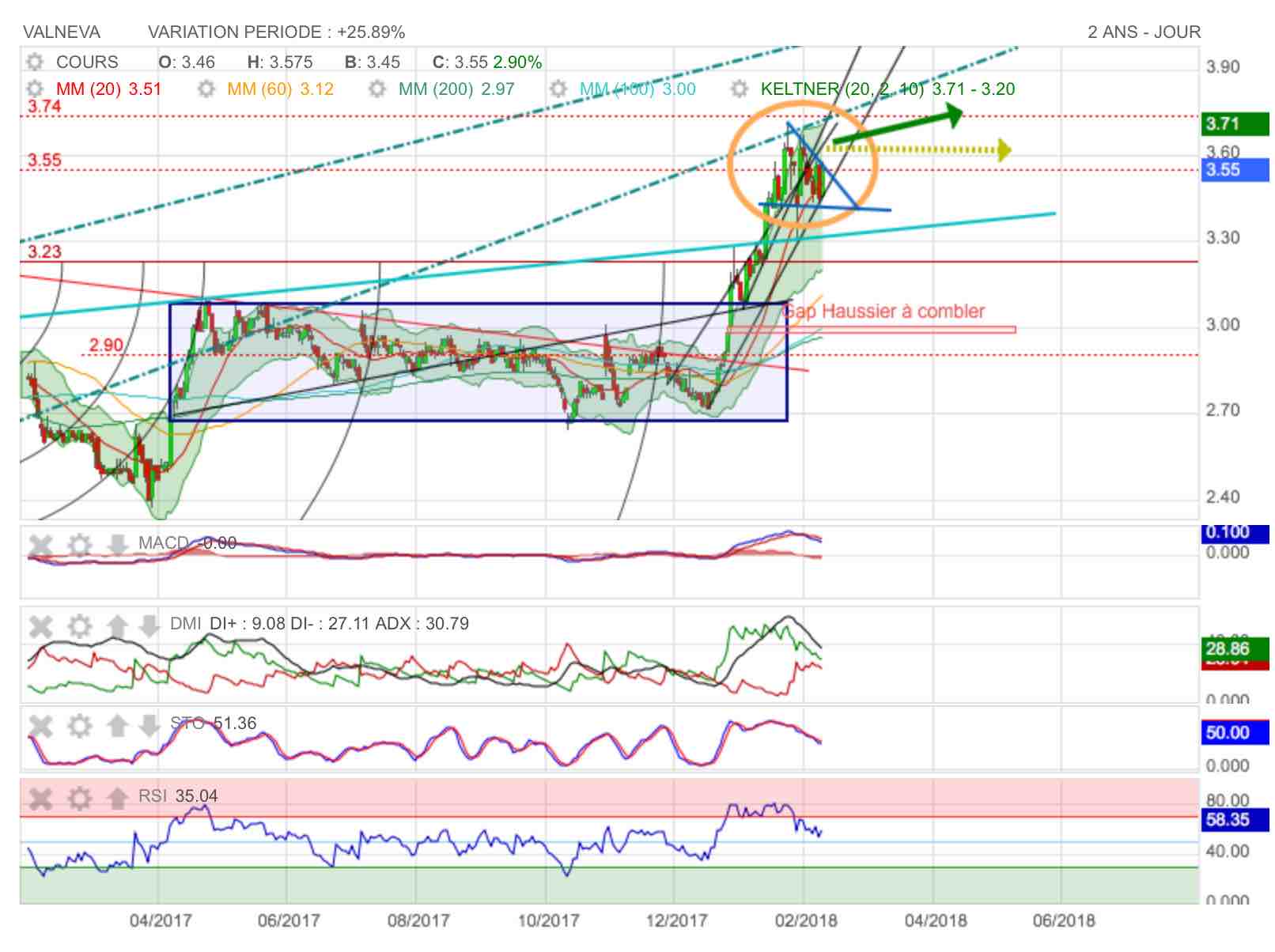
Le fanion figure en bleu sur le graphe. on constate que malgré le repli des indicateurs, les cours ne perdent que peu de terrain à la baisse. Ce refroidissement des indicateurs graphiques après la violente surchauffe de RSI est très opportun : il devrait permettre de retourner visiter les 3,70 et d'inscrire de nouveaux plus hauts annuels...
On notera encore dans le post précédent l'excellente publication de CA annuel de cette semaine.
.
|
Répondre
|
 1
1
Et merci pour tes analyses
|
Répondre
|
VALNEVA : croissance du CA annuel à 12 % en 2017
15/02/2018 | 08:52
Valneva a réalisé en 2017 un chiffre d'affaires de 109,8 millions d'euros, en hausse de 12%. Les ventes de produits ont atteint 92,6 millions, en progression de 15%. La trésorerie de la biotech spécialisée dans les vaccins est ressortie au 31 décembre 2017 à 38,1 millions contre 42,2 millions un an plus tôt.
David Lawrence, directeur financier du groupe, a indiqué, “La performance de notre chiffre d'affaires annuel résulte principalement de la très bonne exécution de notre stratégie et notamment du développement continu de nos capacités commerciales. Le niveau de notre trésorerie souligne également la bonne santé de notre bilan et sa capacité à soutenir les investissements en R&D et le remboursement de nos emprunts".
|
Répondre
|
Mes prévisions de CA 2017 annuel :
Sur la base à 9 mois, je table sur un haut de fourchette vers 109,6 Md'e. avec un petit bonus de dernier trimestre d'exercice traditionnellement plus elevé... et donc le T4 pour passer les 30 Md'e de CA (soit au global 111 à 112 Md'e).
Les comptes devraient s'assainir nettement.
Valvena a donné en novembre derrnier une confirmation de la prévision de chiffre d’affaires annuel dans la fourchette de €105-115 millions précédemment annoncée.
-----------------------------------------------------
NB : positionné avec mon PEA 2, j'ai un PRU de 2,94 euros.
Calendrier Investisseur 2018
.
|
Répondre
|
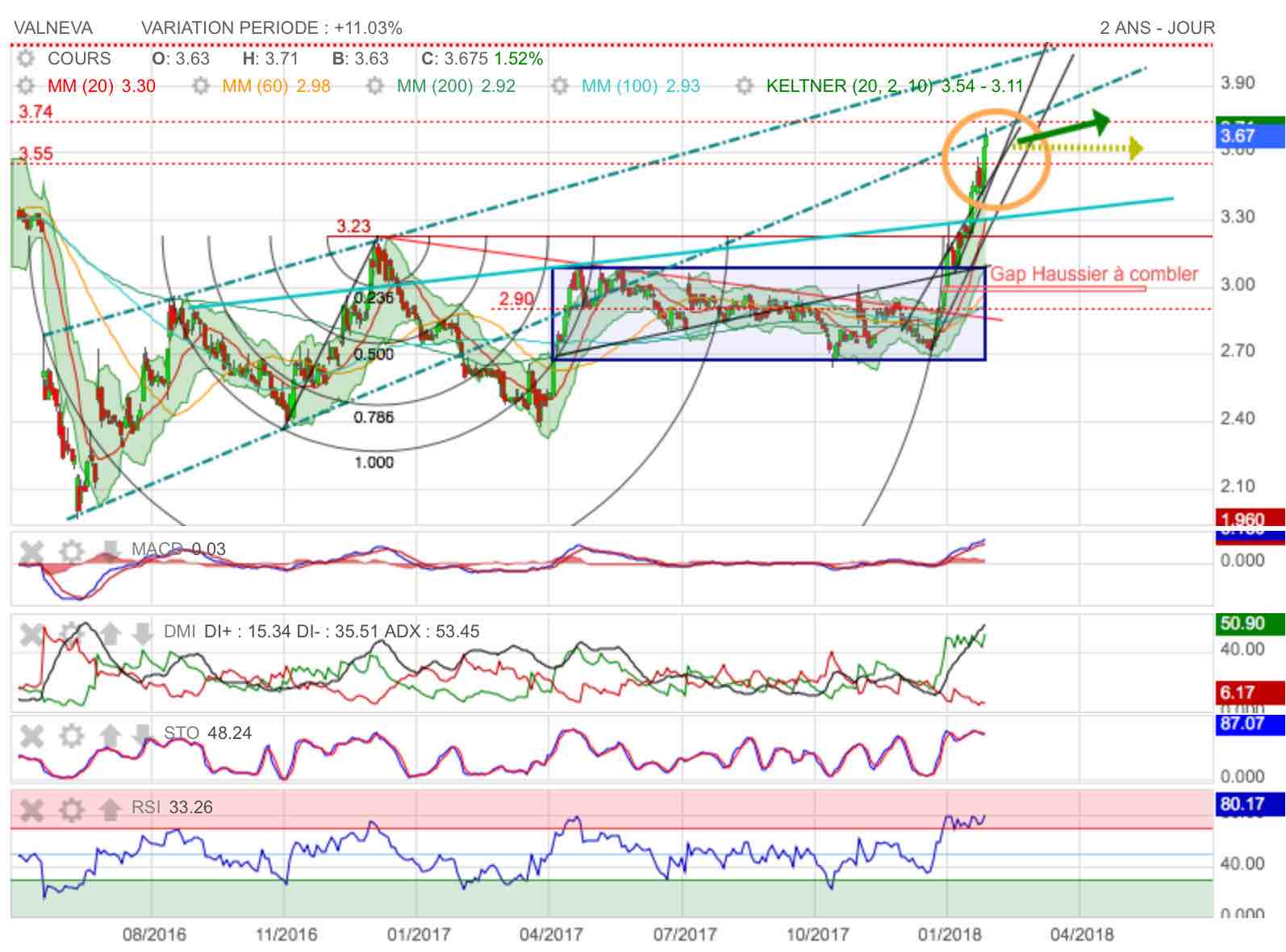
On vient actuellement de subir une très forte poussée haussière en sortie des arc de fibonacci. Cela nous permis de dépasser un premier niveau de résistance (oblique en Bleu clair). On vient se jour de se taper la tête à hausse sur un support perdu de canal haussier.
La publication annuelle devrait tomber à point nommé le jeudi 15 Février 2018 pour relancer la hausse et effacer cette résistance.
D'ici, les indicateurs sont en feux à la hausse tellement on a chauffé le fer. Le RSI carraccole au pays des éléphants roses? L'ascension du MACD est violente et reste haussière. La DMI verte sature à la hausse et les stochastiques font ce qui peuvent pour soutenir le niveau de crête.
Coté MM, c'est clairement l'affolement général à la hausse : tout est enfin en ordre de marche et ça monte sec pour la MM 20... La MM 100 bleue à 2,93 vient de passer sur la MM 200 verte à 2,92.
Enfin, la spéculation est active sur le titre : on anticipe de bons chiffres, et donc on est à l'achat fort sur le titre ce qui provoqie une sortir haussière de la bande haute de keltner. Phénomène toujours actif qui pourrait persister encore.
à la hausse, les prochains points de résitance se situent vers 3,74, puis 4,07...
.
|
Répondre
|
Croissance continue des ventes
Sur les neuf premiers mois de l’exercice 2017, le chiffre d’affaires des ventes d’IXIARO®/JESPECT® a atteint €45,9 millions contre €40,1 millions sur la même période de l’année précédente. Cette augmentation a été principalement soutenue par un accroissement des ventes sur les marchés privés britannique, allemand et canadien ainsi qu’à l’armée américaine. Valneva a annoncé début novembre la signature d’un nouveau contrat avec l’armée américaine d’une valeur maximale de $39,6 millions.
(extrait de la dernière publication trimestrielle à 9 mois)
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !