CROSSJECT - News - Reco - Page 4
Cours temps réel: 2,35 0,43%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
Maxim Group initie la couverture de l'action CROSSJECT avec une note à l’achat et un prix cible de 4,00 €
03/06/2025
Communiqué de presse
Dijon, France le 3 juin 2025 (07h30 CET) -- CROSSJECT (ISIN: FR0011716265; Euronext: ALCJ), la société pharmaceutique de spécialités qui développe des produits dédiés aux situations d’urgence fondés sur sa technologie propriétaire d’auto-injecteurs sans aiguille ZENEO®, informe de la récente mise en place d'une couverture par Maxim Group, la société de courtage américaine spécialisée dans les sociétés biopharmaceutiques et sociétés de technologie émergentes.
Dans son premier rapport intitulé “A Robust Needle-Free Auto-Injector Platform for Emergency Therapies”, Le service de recherche actions de Maxim Group a émis une première recommandation d'achat (BUY) sur l'action CROSSJECT avec un prix cible de 4,00 euros, Le prix de clôture de l’action CROSSJECT le 29 mai 2025, date d’émission de ce rapport, était de 1,77 euros.
« Nous sommes ravis de ce premier soutien de la part d'une société de courtage de premier plan aux États-Unis, spécialisée dans les sociétés émergentes dans les sciences de la vie. Nous sommes impatients d'alimenter la communauté des investisseurs nord-américains avec d'autres développements positifs en relation avec l'enregistrement de ZEPIZURE® auprès de la FDA et avec le reste de notre pipeline. », a dit Patrick ALEXANDRE, Président du Directoire de CROSSJECT.
|
Répondre
|
Juste pour montrer la pertinence du support 1.69/1.65€ sur le moyent terme 
Biensur ce qui craint sur ce titre, ce sont les AK à base d'Oca 
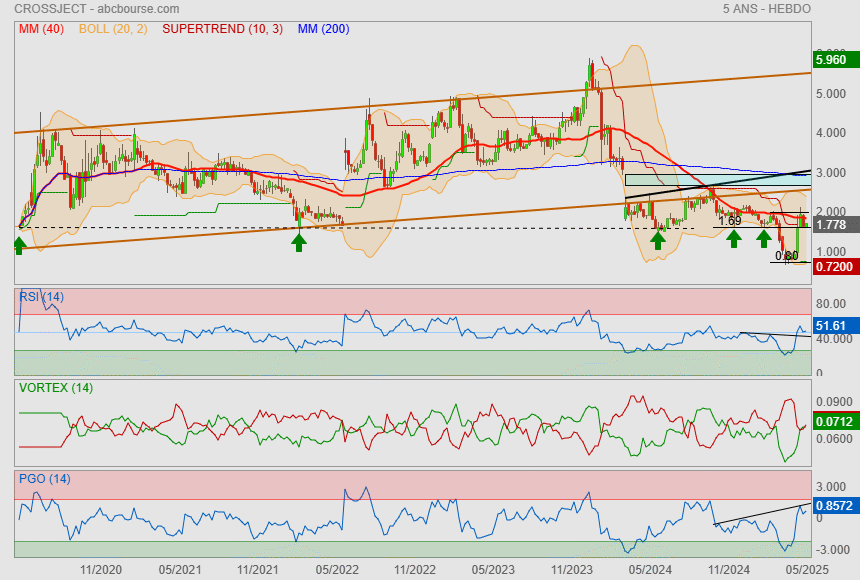
|
Répondre
|
Pour le moment, c'est chirurgicale !
1.69 servant de support
L'espoir est que ça tienne afin que le titre puisse retourner jouer avec son gap.
ce qui donnerai un bel upside au passage ! 
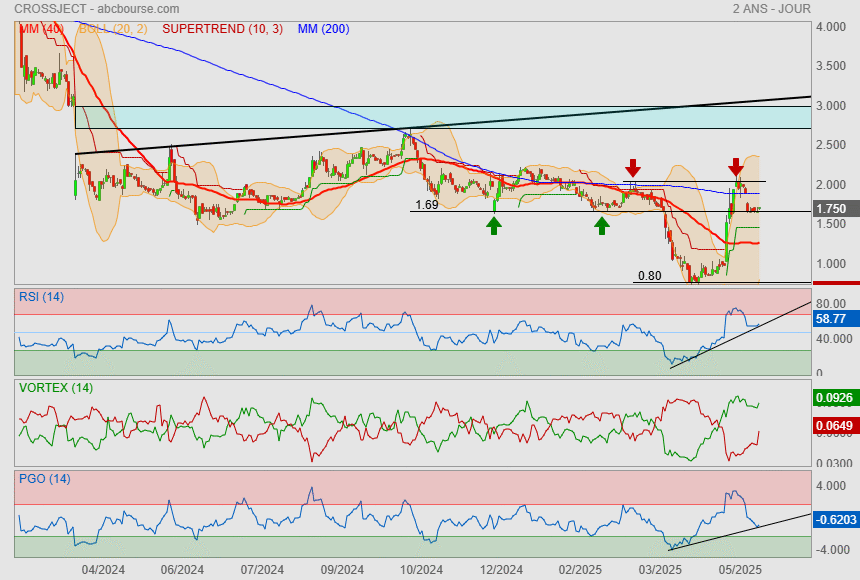
|
Répondre
|
27/05/2025
Communiqué de presse
CROSSJECT met en place un nouveau module de fabrication pour augmenter la polyvalence et la capacité de la ZENEO® Factory en prévision du déploiement de l'ensemble de son portefeuille de produits
CROSSJECT a développé le ZENEO® Nest, un nouveau module pour améliorer le remplissage aseptique par lots des conteneurs à médicament propriétaires en verre au sein du dispositif ZENEO®. Mise en œuvre prévue d'ici décembre 2025.
Fidèle à sa stratégie de diversification de ses financements, CROSSJECT a obtenu un nouveau financement spécifique pour finaliser la mise en œuvre du ZENEO® Nest.
Dijon, France 27 mai 2025 (07h30 CET) -- CROSSJECT (ISIN: FR0011716265; Euronext: ALCJ), une société pharmaceutique de spécialités qui développe des produits dédiés aux situations d’urgence fondés sur sa technologie propriétaire d’auto-injecteurs sans aiguille ZENEO®, augmente la capacité de la ZENEO® Factory dans une étape clé du processus de fabrication. La mise en œuvre de cette innovation, prévue pour 2025, est une étape stratégique en prévision du déploiement à grande échelle de ZEPIZURE® et des autres produits candidats de son pipeline.
CROSSJECT a développé le ZENEO® Nest, un nouveau module pour faciliter le remplissage aseptique automatisé et à haut volume du conteneur à médicament propriétaire en verre à l'intérieur du dispositif ZENEO®. Le ZENEO® Nest pré-assemble les conteneurs pour un remplissage plus rapide, ce qui se traduit par des volumes plus importants par jour dans les unités de salles réservées auprès des partenaires CDMO de CROSSJECT. Plus important encore, le ZENEO® Nest a été conçu pour être compatible avec de nombreux équipements de remplissage ou lignes d'équipement dans l'industrie CDMO. Ainsi, CROSSJECT est en mesure de mettre en place des unités de remplissage entièrement prêtes à l'emploi au sein de partenaires CDMO en France ou dans n'importe quelle zone géographique, au fur et à mesure que la demande pour ses produits augmente.
Le premier ZENEO® Nest a été expérimenté avec succès avec EUROFINS, qui sera l'utilisateur initial. CROSSJECT prévoit une mise en œuvre rapide et complète d'ici décembre 2025 du ZENEO® Nest dans son usine de Dijon, suivie des étapes de qualification et de validation finales d'ici le premier trimestre 2026.
« Nous sommes très satisfaits de cette innovation dans notre processus de fabrication, l'une des racines de l'excellence de CROSSJECT. Le ZENEO® Nest contribue à la fois à accroître notre contrôle sur la productivité et la qualité de notre processus de remplissage, à améliorer notre agilité dans l'établissement de relations CDMO pour des volumes importants à l'échelle internationale, et à réduire notre coût de revient unitaire. », mentionne Patrick ALEXANDRE, CEO de CROSSJECT.
Le déploiement du ZENEO® Nest est en partie financé par un crédit d'équipement auprès de LCL, nouveau partenaire bancaire de CROSSJECT, constant dans sa stratégie de diversification de ses sources de financement.
|
Répondre
|
C'est quand même toujours aussi abusé de sortir un communiqué d'AK sans même en donner le prix 
le marché lui à l'air de le connaitre 
|
Répondre
|
CROSSJECT PRÉPARE LE LANCEMENT D'UNE AUGMENTATION DE CAPITAL AVEC MAINTIEN DU DROIT PRÉFÉRENTIEL DE SOUSCRIPTION D'UN MONTANT D'ENVIRON 5 ME
20/05/2025
CROSSJECT, senvisage, début juin, le lancement d'une augmentation de capital avec maintien du droit préférentiel de souscription ("DPS"), d'un montant global d'environ 5 millions d'euros susceptible d'être porté à environ 5,8 millions d'euros en cas d'exercice de la clause d'extension.
Patrick ALEXANDRE, Président du Directoire de CROSSJECT, a souligné : "Dans la continuité de nos progrès vers un dépôt rapide du dossier ZEPIZURE auprès de la FDA dans le cadre de la procédure EUA, nous souhaitons disposer des ressources nécessaires et de la flexibilité financière qui nous permettront de satisfaire les demandes de notre partenaire US. Sous condition de l'approbation FDA, toute notre équipe est focalisée sur notre capacité à livrer en réponse au programme CHEMPACK en soutien à la préparation nationale américaine contre les menaces chimiques. Nous continuons aussi d'être proactifs sur la construction de notre infrastructure commerciale aux Etats-Unis."
Modalités de l'augmentation de capital
La levée de fonds envisagée consisterait en une augmentation de capital par émission d'actions nouvelles avec maintien du DPS.
L'augmentation de capital serait décidée, conformément à l'autorisation consentie par le Conseil de Surveillance, dans sa séance du 19 mai 2025 et à la 7ème résolution adoptée par l'Assemblée Générale des actionnaires du 27 juin 2024 aux termes de laquelle l'Assemblée a délégué sa compétence au directoire pour émettre des actions ordinaires avec maintien du droit préférentiel de souscription dans la limite d'un montant nominal d'augmentation de capital de 900.000 euros, compte non tenu de l'éventuelle préservation des droits.
L'opération fera l'objet d'un communiqué spécifique lors de la décision de lancement qui en précisera les modalités ainsi que son calendrier. Dans la perspective de l'opération, CROSSJECT devrait prochainement suspendre l'exercice des instruments dilutifs (BSA et OCAs).
Objectifs de l'Augmentation de capital
Comme annoncé le 7 mai dernier, CROSSJECT continue de se concentrer sur la préparation de la demande de l'autorisation EUA auprès de la FDA et reste alignée avec les délais prévus pour finaliser les opérations de production des lots de validations en juin.
En outre, CROSSJECT a démarré un premier cycle de fabrication des lots EUA, destinés à la première livraison du programme CHEMPACK dans le cadre de la préparation nationale américaine contre les menaces chimiques, en accord avec son partenaire américain, la Biomedical Advanced Research and Development Authority (BARDA). CROSSJECT continue d'allouer une portion importante de ses ressources aussi à son infrastructure aux Etats-Unis et à ses autres produits candidats.
|
Répondre
|
Piqure de rappel !
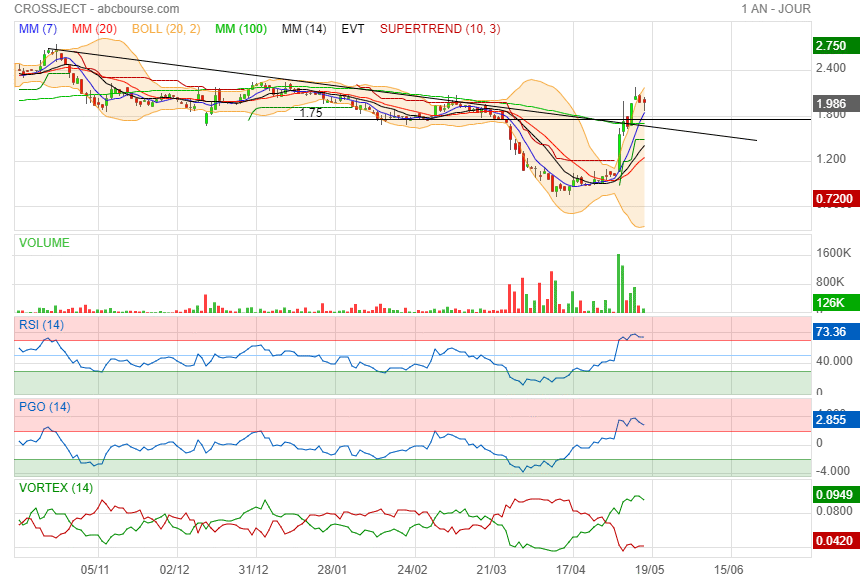
|
Répondre
|
Publié le 15/05/2025 à 10:33
En dépit de l’annonce de nouvelles encourageantes, le titre Crossject est en net repli (- 3,07 % à 1,924 euros).
Pourtant, la société pharmaceutique a dévoilé d’excellents résultats pour son auto-injecteur Zeneo dans le cadre d’une nouvelle étude d’évaluation de profondeur par imagerie par résonance magnétique (IRM).
Ces derniers ont révélé que la profondeur d’injection de Zeneo correspondait à celle des aiguilles intramusculaires conventionnelles de 30 mm et surpassait la longueur des aiguilles intégrées aux auto-injecteurs à aiguilles traditionnelles.
Par ailleurs, le produit de Crossject a démontré son potentiel d'adoption commerciale en éliminant les erreurs d'utilisation et en reproduisant de façon fidèle l'injection intramusculaire traditionnelle.
A suivre... 🧐
|
Répondre
|
Belle éclaircie ! Mais il y a encore du chemin à faire ... 👀🔎
|
Répondre
|
ding dong
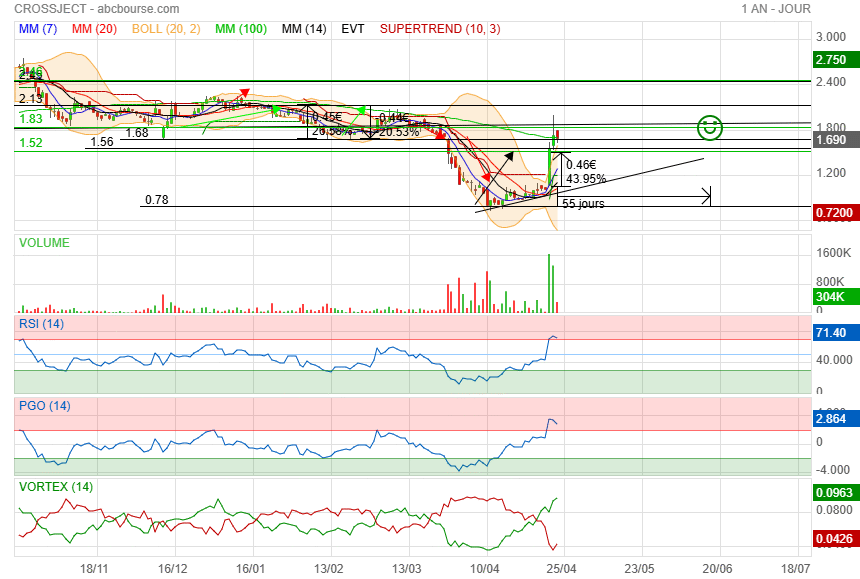
|
Répondre
|
Et que ce sera le moment d'en prendre une louche (chacun sa taille de louche en fonction de son appétit) avant la prochaine étape, le dépôt du dossier qui doit avoir lieu dans les deux mois à venir.
|
Répondre
|
on dirait que ca va consolider entre 1.55 et 1.65 à voir !
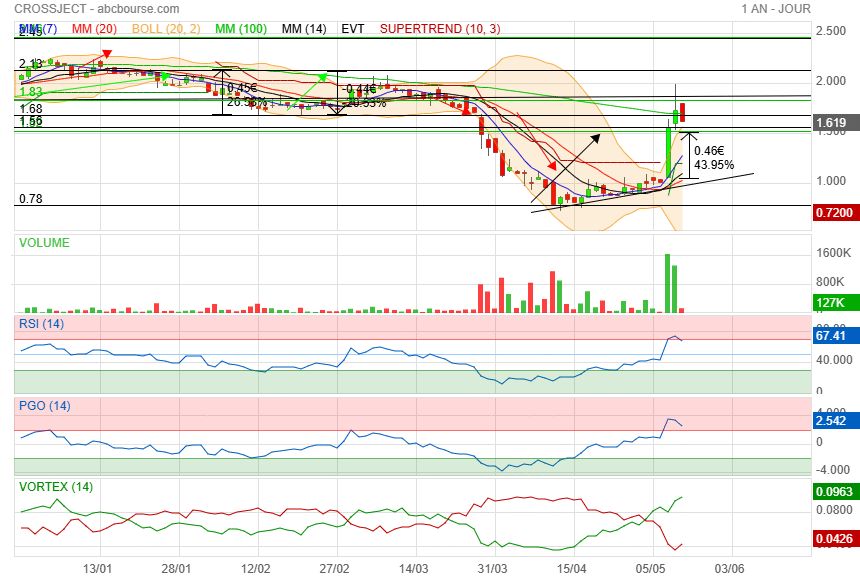
|
Répondre
|
CROSSJECT : Retour à la vie?
Publié le 07/05/2025 à 18:24
CROSSJECT a fourni une mise à jour sur le dépôt de l’EUA pour Zepizure. La direction a confirmé que le dépôt aura lieu en juin 2025, comme indiqué précédemment, démontrant ainsi leur respect du calendrier. Ce développement est susceptible de renforcer la confiance des investisseurs, qui avait récemment diminué. Par conséquent, le marché a réagi positivement, bien que le lancement réussi de Zeneo ne soit pas encore pleinement reflété dans le prix de l’action. Notre prix cible reste inchangé à 6,76 €.
ACTUALITÉ
Crossject et son partenaire CDMO, Eurofins, ont réussi à remplir aseptiquement tous les lots d’enregistrement de ZEPIZURE®. Ils prévoient de fournir les dernières données de fabrication nécessaires pour la soumission de l’Autorisation d’Utilisation d’Urgence (EUA) de la FDA américaine d’ici juin 2025. Crossject a initié les dernières activités réglementaires pour la soumission du dossier Zepizure sous l’EUA. Le groupe a commencé la fabrication de lots EUA, qui sont destinés à la première livraison au “programme Chempack”, soutenant la préparation nationale américaine contre les menaces chimiques.
ANALYSE
Eurofins a réussi à terminer la production de lots de Zepizure, comme l’a rapporté la direction de Crossject. L’assemblage final et l’emballage se déroulent comme prévu. Les données finales de fabrication seront soumises dès qu’elles seront disponibles, avec un premier retour de la FDA attendu dans un délai d’un mois après la soumission, confirmant la réception du dossier complet.
Le développement positif confirme que le dossier sera déposé dans le délai prévu de deux mois, une réalisation significative compte tenu des défis historiques du groupe. Le marché a réagi fortement, avec une augmentation du prix de l’action de plus de 50%. Cependant, il est important de noter que le prix de l’action reste bas, ayant diminué de 40% au cours des 12 derniers mois et de 55% sur deux ans. Auparavant, la confiance du marché avait diminué en raison de retards dans la feuille de route du groupe et d’une communication incohérente. Cependant, cette tendance semble s’inverser.
Nous maintenons notre point de vue selon lequel le succès de Zeneo n’est pas encore pleinement reflété dans le prix de l’action, comme l’indique notre prix cible actuel de 6,76 €.
IMPACT
Nous maintiendrons nos prévisions actuelles pour la sortie. Cependant, les nouvelles d’aujourd’hui sont rassurantes et indiquent que le groupe pourrait réaliser ses premières ventes en FY25.
|
Répondre
|
Parfait très belle hausse avec du volume
Résistance 1.57
On verra bien ces prochains jours si ca passe ou si ca consolide !
perso presque tout vendu sur 1.44 puis 1.54
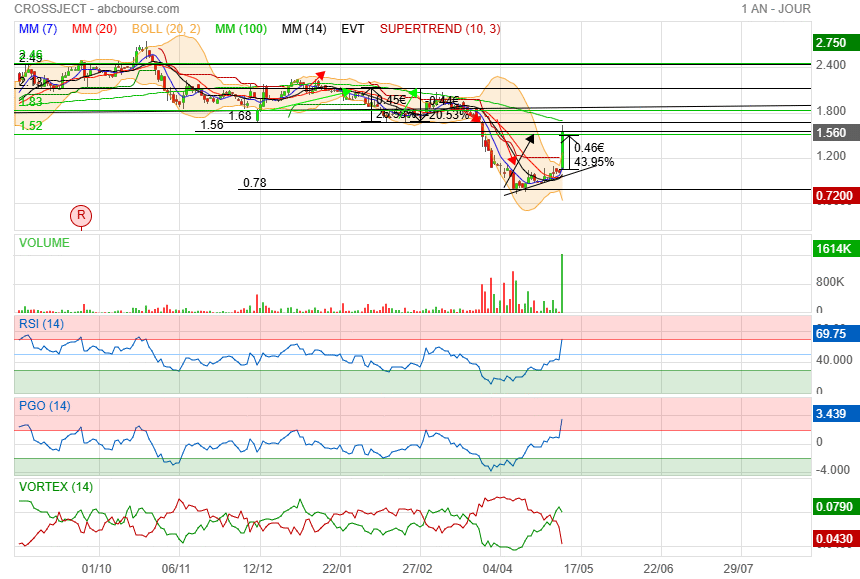
|
Répondre
|
Effectivement ! mais rien est jamais sure a 100 % savoir prendre une partie de ses bénéfices m'a toujours permis de m'en sortir sans prendre trop de risque et si elle continue de monter il me reste encore mes 2/3 de ma ligne et depuis 5 ans avec crossject on en a eu des surprises ! bonnes et mauvaises sur les bonnes j ai souvent vendu et j ai pu racheter sur les mauvaises et depuis hier mon portif est de nouveau passé positif et samedi je pars en vacances
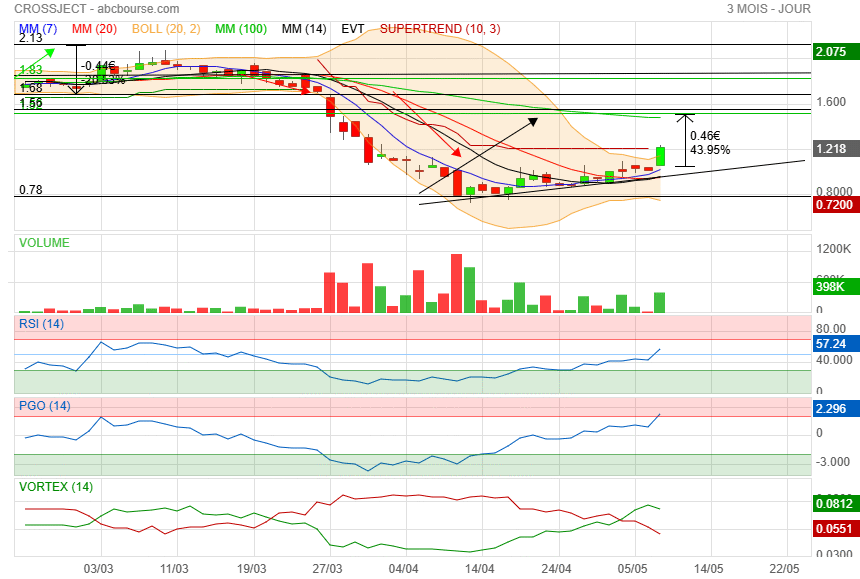
|
Répondre
|
@ philiberts
Il semble pourtant que l'on soit sur la bonne voie ... 📈👏🏻
|
Répondre
|
De mon coté j ai vendu 1/3 de ma ligne sur 1.13
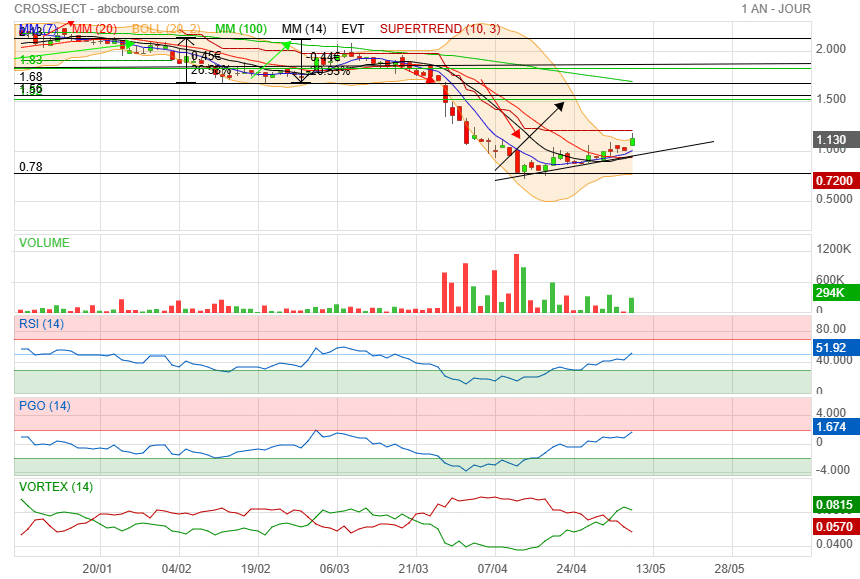
|
Répondre
|
Crossject fait un point sur les dernières avancées dans le dépôt de la demande EUA de ZEPIZURE
07/05/2025
Crossject , fait le point sur le processus de dépôt du dossier de ZEPIZURE auprès de la FDA dans le cadre de l'autorisation d'utilisation d'urgence (EUA), en accord avec son partenaire américain, la Biomedical Advanced Research and Development Authority (BARDA) au sein du Ministère américain de la Santé et des Services Sociaux.
Les étapes critiques de remplissage aseptique attendues dans la fabrication des lots de ZEPIZURE ont été réalisées avec succès par EUROFINS, à la date de ce communiqué. Depuis le début de l'année 2025, CROSSJECT a alloué des ressources supplémentaires à son processus de fabrication de ZEPIZURE afin de limiter tout retard et de traiter rapidement les aspects réglementaires. Les étapes d'assemblage final, de conditionnement et de libération des lots seront finalisées comme prévu.
Le transfert du dossier ZEPIZURE dans la plateforme de soumission a commencé et les données de fabrication finales seront insérées dès que disponibles. Un premier retour de la FDA, limité à la confirmation de la réception positive d'un dossier complet, est attendu dans le mois suivant la soumission. En outre, CROSSJECT a démarré un premier cycle de fabrication des lots EUA, destinés à la première livraison du programme CHEMPACK.
Nous travaillons activement avec la BARDA pour finaliser le dossier EUA de ZEPIZURE et sommes confiants d'être en ligne avec les délais prévus à court terme pour la soumission à la FDA. Le dossier EUA sera soumis par BARDA dès que les données de fabrication requises auront été ajoutées. Nous sommes impatients de fournir ZEPIZURE au programme américain CHEMPACK, en soutien à la préparation nationale des États-Unis contre les menaces chimiques, dès que la FDA aura donné son autorisation" a déclaré Isabelle LIEBSCHUTZ, Directrice Qualité et Règlementaire de CROSSJECT.
Nous sommes extrêmement reconnaissants à la BARDA pour son assistance technique et son soutien dans le cadre du dépôt de ZEPIZURE dans les délais impartis. Nous nous réjouissons de cette étape importante qui nous permettra d'avancer vers une nouvelle solution pour le traitement de l'état de mal épileptique. Au-delà de ZEPIZURE, ce nouveau niveau de validation établit ZENEO comme une technologie injectable innovante et au large potentiel. Ce succès va nous permettre de poursuivre nos ambitions en matière de nouvelles formulations de médicaments avec ZENEO, de satisfaire nos partenaires actuels et d'alimenter nos activités de business développement", a ajouté Patrick ALEXANDRE, Président du Directoire de CROSSJECT.
|
Répondre
|
Moi ce qui me dérange c'est les Oca 
Mais graphiquement, ça devient intéressant à jouer je trouve.
les indicateurs sont haussiers depuis le 1er avril et forment même une divergence haussière.
je la verrais bien sortir de son statut de penny stock 
|
Répondre
|
Feu de paille ? faudrait qu elle passe au-dessus de 0.91
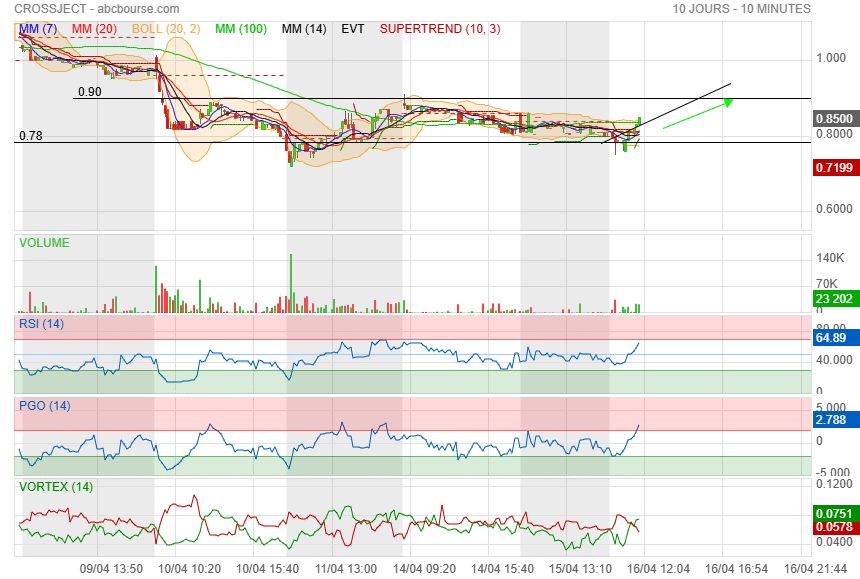
|
Répondre
|

 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !