CROSSJECT - News - Reco - Page 7
Cours temps réel: 2,35 0,43%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
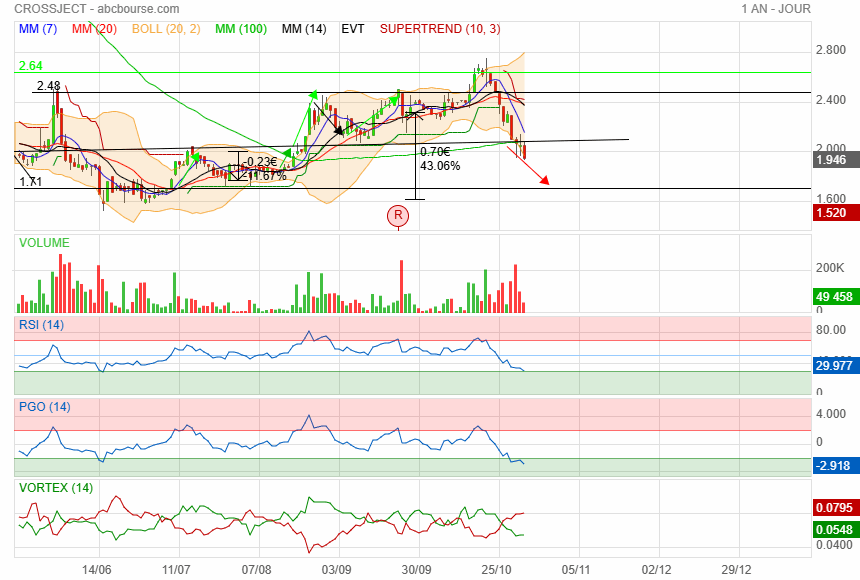
support des 2 n a pas tenu
direction vers les plus bas vers 1.70
|
Répondre
|
Xavière Castano, co-fondatrice du laboratoire pharmaceutique Crossject, directrice RSE et relations publiques
Interview
Crossject, l'injecteur sans aiguille pour les médicaments d'urgence
Présentez-nous votre rôle chez Crossject ?
Depuis le début du projet, nous nous sommes répartis les rôles avec Patrick Alexandre. En tant que directeur général, il est concentré désormais sur notre stratégie commerciale aux Etats-Unis. De mon côté je reste plus locale et je m’occupe des relations publiques et institutionnelles en Bourgogne-Franche-Comté, ainsi que de la RSE. Je suis là pour vulgariser, faire découvrir l’aventure entrepreneuriale de Crossject : je partage la passion que j’ai pour ce projet depuis plus de 20 ans. Il est parfois difficile d’expliquer pourquoi c’est si long et si complexe au grand public, aux financiers et à nos parties prenantes. Ce sont nos avancées et tous les enjeux sur lesquels nous travaillons depuis plus de vingt ans d’existence. Titulaire d’un double diplôme de pharmacienne et d’ingénieur spécialisé dans les matériaux, j’étais dès le début du projet à l’interface technique et règlementaire de notre Zeneo®. Travailler un système ultra innovant d’injecteur sans aiguille pour des médicaments d’urgence, notre concept, est passionnant mais exigeant en termes de persévérance. C’était au début du projet. Je n’ai pas vu passer les 10 années de recherche et développement de Zeneo® car le produit avançait aussi vite que nous réussissions à trouver des financements et des clients !
En quoi le Covid a-t-il fortement modifié la donne pour vous ?
Au départ du projet, nos clients venaient de l’industrie pharmaceutique et nous mettions leurs molécules dans notre système. A cette époque, s’auto-injecter un médicament n’était pas encore dans l’air du temps … sauf qu’avec le Covid, le patient a gagné en connaissance et en autonomie sur un tas d’application. Lier cela à la didactisation via les réseaux sociaux et aux tutos en tous genres, la façon de voir la prise médicamenteuse n’est plus la même, le curseur a changé de place !
Le marché décroché aux Etats-Unis a-t-il marqué un tournant ?
Le contrat de 155 millions de dollars signé avec la Biomedical Advanced Research and Development Authority (BARDA) pour la production d’unités de solutions injectables destinées à interagir en cas d’attaque chimique a évidemment positionné notre énergie et nos ressources vers les Etats-Unis. Ce nouveau produit s’appelle Zepizure®. Nous avons embauché dernièrement deux nouveaux salariés américains sur 120 personnes au total actuellement. Nous pourrons atteindre la rentabilité de Crossject grâce aux seules ventes de Zepizure® sur le marché américain. Nous prévoyons de déposer une demande d'Autorisation d'Utilisation d'Urgence (EUA) de Zepizure® au début de l’année 2025, et nous devrions obtenir une réponse de la FDA (Food and Drug Administration) peu de temps après.
Quels sont vos missions phares en matière de RSE ?
Notre diagnostic développement durable / RSE a été établi en 2019. Les résultats de cette analyse étaient bons. Nous avons formalisé nos acquis et établi une feuille de route pour progresser sur ce sujet structurant et stratégique pour les entreprises. Nos deux sujets de 2024 sont la qualité de vie au travail et la mobilité douce. Pour être plus nombreux et donc efficaces sur ces thématiques, j’ai rejoint le bureau du Medef Côte-d’Or ainsi que le conseil d’administration de l’Université de Bourgogne en tant que voisins : Crossject a ses bureaux sur la zone Mazen-Sully. Nous nous sommes également lancés dans une analyse du cycle de vie de notre injecteur et de l’ensemble de ses 30 composants. Notre objectif est pouvoir établir le bilan carbone de notre Zeneo®.
|
Répondre
|
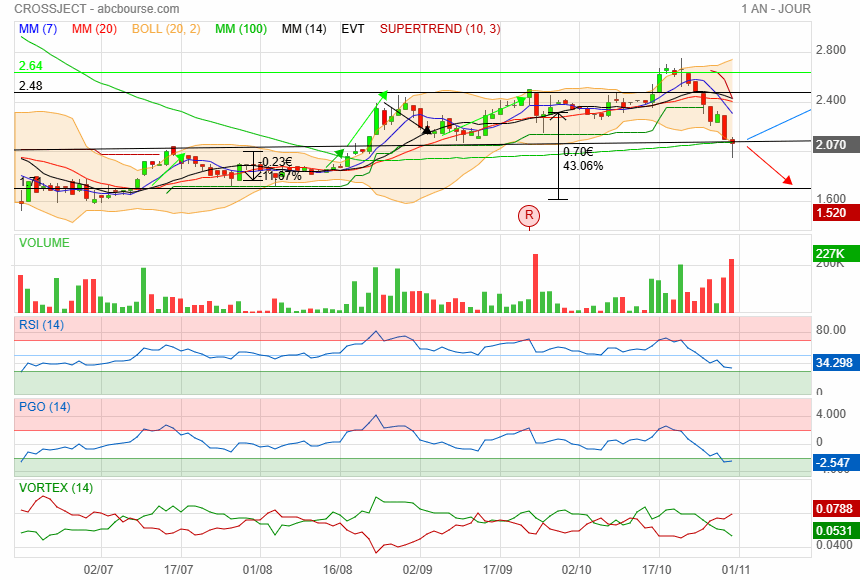
piqure de rappel
1899 : Letitia Geer invente la première seringue médicale utilisable d'une seule main !
Si la technologie bidon dure aussi longtemps c'est bien !
|
Répondre
|
 0
0
SOCIETE BIDON
LA TECHNOLOGIE DATE DE 2003 !!!!!!!!!!!!
|
Répondre
|
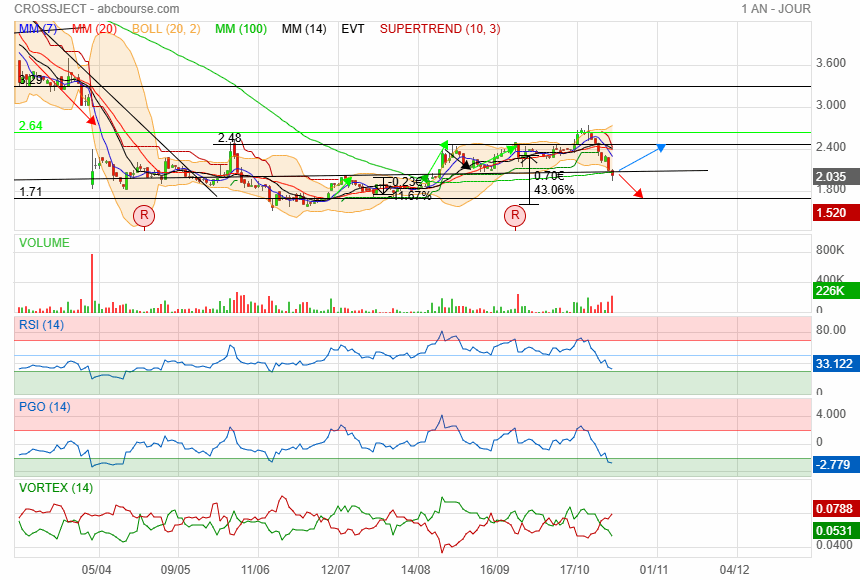
entrain de casser son support des 2.07
soit ca rebondit soit direction prochain support des 1.70
|
Répondre
|
CROSSJECT NEWS - OCTOBRE 2024
17/10/2024
Être en mesure de déposer début 2025 notre demande d’autorisation d’urgence de mise sur le marché américain pour ZEPIZURE®, notre solution contre les crises d’épilepsie, est évidemment un objectif majeur et un premier aboutissement concret pour nos équipes, engagées depuis le premier jour.
Mais l’essentiel est sans doute ailleurs. En effet, cette perspective très positive est aussi la preuve tangible d’un changement d’ère pour CROSSJECT. Pour dire les choses simplement, nous avons réussi à « dérisquer » l’entreprise dans toutes ses dimensions.
D’abord, la portée thérapeutique en matière d’urgence vitale de notre plateforme ZENEO® associée à une molécule éprouvée est largement démontrée. Le bilan des différentes études cliniques que nous avons pu conduire au fil des années est éloquent. Leur contenu est d’ailleurs une des matières premières des dossiers réglementaires que nous constituons en amont de nos demandes d’autorisation de mise sur le marché.
Ensuite les audits réguliers de notre système qualité et de nos unités de production menés par la BARDA* ou par des organismes certificateurs, attestent de notre capacité à fabriquer les produits qui seront commercialisés. La sécurisation de notre supply chain (en interne et en externe) a été au cœur de nos activités ces dernières années. En donnant la priorité à l’efficience, nous nous sommes focalisés sur la maîtrise de la qualité à toutes les étapes. Le focus de cette Newsletter détaille les principes de notre politique de relation fournisseurs, pierre angulaire de cette performance globale.
Enfin, la distribution de nos solutions repose également sur une stratégie solidement assise. Le principe, c’est le sur-mesure par aire géographique et par produit. En fonction de l’indication et du territoire, nous privilégions soit l’accord de partenariat, soit la distribution directe. Par exemple, ZENEO® Hydrocortisone, traitement d’urgence dans la prise en charge des crises d’insuffisance surrénalienne aigüe, sera distribué via un partenaire aux États-Unis et directement en Europe.
Les pratiques médicales, commerciales et la prise en charge des dépenses de santé sont très différentes d’un continent à l’autre. C’est pourquoi nous étoffons en parallèle nos équipes commerciales des deux côtés de l’Atlantique. Aux États-Unis, nous avons ainsi recruté un Directeur Médical, Dan CHICHE et un Directeur des Opérations, Tony TIPTON, dont la mission première est d’imposer ZEPIZURE® (contre les crises d’épilepsie) sur le continent américain.
Ultime satisfecit : la reconnaissance de notre contribution à la souveraineté sanitaire française. En effet, si France 2030 nous donne les moyens d’accélérer le développement de ZENEO® Adrénaline, c’est parce que notre solution est reconnue comme un dispositif stratégique. Notre plateforme répond au défi de la disponibilité d’une solution locale et fiable avec l’avantage d’une facilité d’administration pour sauver des vies !
Patrick ALEXANDRE, PDG et Fondateur de CROSSJECT
* Contrat BARDA 75A50122C00031
|
Répondre
|
Le 25 septembre 2024
H1 24 : pas de vraie surprise, mais une once de déception
La société a publié ses chiffres du premier semestre 24 et rappelé les jalons atteints au cours des derniers mois. Même si nous croyons toujours en la proposition d’investissement, nous sommes un peu perplexes quant à la capacité du groupe à lancer ses produits sur le marché sans un autre round de financement. Nous constatons également que la direction fait preuve d’une certaine prudence en ce qui concerne le calendrier dudit lancement. Simple façon de ne pas risquer de décevoir les investisseurs ou signe que les choses peuvent se compliquer, l’avenir le dira
ACTUALITÉ
Crossject a publié les résultats du premier semestre 24. Les revenus ont atteint 5 766k € contre 7 926k €, le résultat d’exploitation -6 719k € contre -6 535k €, et le résultat net -6 402k € contre -4 562k €. La trésorerie brute à la fin du premier semestre 24 s’élevait à 5,9M € contre 5,4M € un an auparavant et 2,3M € à la fin de l’exercice 23.
ANALYSE
Une fois de plus, nous rappelons que les chiffres ont peu de pertinence pour le moment car l’histoire du groupe est basée sur le futur lancement de Zeneo et non sur des publications “immédiates”. Cela dit, la “bonne nouvelle” est que le résultat net est à peu près le même que l’année dernière. En fait, un niveau d’amortissement plus bas de la production capitalisée compense des revenus plus faibles, ce qui rend la nouvelle un peu moins “spectaculaire”.
La consommation de trésorerie semble raisonnablement contenue même si la dette nette n’est pas publiée à ce stade (nous calculons cette consommation de trésorerie à environ €8m et la liquidité est préservée (trésorerie brute de €5,9m d’euros, en hausse de €3,6m depuis décembre), le groupe ayant levé environ 6,7 millions d’euros lors de l’augmentation de capital de juin et encaissé environ €6,3m grâce à l’émission d’obligations convertibles et/ou remboursables en deux tranches (la seconde n’étant pas activable avant que Zepizure obtienne l’EUA aux États-Unis) auprès de Heights Capital Management en février tandis que la dette bancaire brute est également en baisse d’environ €1,6m).
Notons que les revenus du S124 incluent 3,2m dans le cadre de la coopération avec la BARDA (Biomedical Advanced Research and Development Authority). Pour rappel, le contrat pourrait valoir 155 millions de dollars au total pour le groupe français si toutes les options sont exercées.
Cependant, nous sommes un peu déçus par certains éléments dans ses résultats et leur présentation :
1- En commençant par la communication du groupe ; nous regrettons une fois de plus que l’ensemble des comptes ne soit pas plus détaillé (par exemple, aucun état des flux de trésorerie n’est fourni ou des notes plus explicites aux comptes). Un “détail”, certes.
2- En ce qui concerne l’EUA pour Zepizure aux États-Unis, nous sommes plutôt troublé par le fait que la direction mentionne oralement “la première partie de l’exercice 2025” ou parfois “le début de l’année” ou “tôt dans l’année prochaine” alors que la présentation de l’année dernière mentionnait explicitement le Q125. Il convient également de mentionner que la même présentation en 2023 indiquait “une réponse de la FDA au Q125”, ce qui à notre avis était évidemment une approbation potentielle et non simplement le dépôt. Cette approbation est maintenant considérée comme “pas beaucoup plus tard” (quel que soit le sens de cette expression et, on pourrait ajouter, pas beaucoup plus tard que le Q125 ou pas beaucoup plus tard que “dans la première partie de l’exercice 25”?). Nous comprenons que l’entreprise a peu de visibilité (et aucun moyen d’influencer réellement) ce calendrier, mais le discours et les points de vue de la direction ne sont pas aussi clairs qu’ils pourraient l’être. Nous paraissons peut-être chipoter sur quelques semaines ou mois, mais l’histoire du groupe incite à la prudence en ce qui concerne les retards.
3- Bien que le groupe estime que le financement jusqu’à l’EUA sans recourir au marché est effectivement la feuille de route, la direction reconnaît qu’elle examine également “toutes les alternatives, de préférence non dilutives ou peu dilutives pour sécuriser son développement et faire face à d’éventuels retards”. Compte tenu de la consommation de trésorerie, nous sommes d’accord et osons dire qu’un nouveau tour de financement est à notre avis plutôt probable dans les prochains mois. En bref, nous sommes moins optimistes que le groupe sur cette question. Bien sûr, l’EUA pourrait être accordée “à tout moment” (c’est-à-dire même plus tôt que prévu actuellement) ce qui serait une excellente nouvelle et changerait évidemment notre point de vue.
Le groupe a également rappelé un certain nombre des jalons atteints au S1 24 ou cet été, tels que le dépôt d’une NDA pour ZEPIZURE au S125, l’octroi par le gouvernement français de €6,9m dans le cadre d’un appel à projets sous le Plan France 2030 (dont €1,7m à encaisser au S224), la nomination de Tony Tipton comme directeur des opérations aux États-Unis et du Dr Chiche comme directeur médical, Amérique du Nord. Des points à souligner, qui ne constituent n’est pas de réelles nouvelles bien sûr.
IMPACT
Nous ajusterons nos chiffres pour l’année en cours à la lumière de cette publication. Cela dit, “rien n’a changé” pour l’avenir et nous espérons toujours voir les premières livraisons à BARDA en FY25, nos chiffres au delà de l’année en cours n’étant pas amenés à changer de manière significative, pas plus que notre objectif de cours qui suggère un potentiel important.
|
Répondre
|
Le 23 septembre 2024
Crossject annonce une position de trésorerie de 5,95 millions d'euros à fin juin, contre 2,3 millions d’euros au 31 décembre 2023. Cette medtech spécialisée dans le développement du Zeneo, auto-injecteur sans aiguille primé pour l'administration de médicaments vitaux en situations d'urgence se dit "en bonne voie pour déposer avec succès une demande d'autorisation d'utilisation d'urgence pour son traitement de secours contre l'épilepsie au début de l’année 2025". La perte d'exploitation s'est cependant creusée sur un an de 6,53 à 6,71 millions d'euros au 1er semestre 2024.
La perte nette atteint 6,40 millions d''euros contre 4,56 millions il y a un an.
"Pour le premier semestre 2024, le résultat d'exploitation de Crossject provenant de ses avancées réglementaires avec la Barda s'élève à 3,3 millions de dollars, en légère hausse par rapport aux 3,2 millions de dollars sur la même période en 2023", précise la société, soulignant que ses investissements en R&D "sont restés stables". "La variation du résultat net est principalement due à la dépréciation des titres, aucun changement significatif n'étant imputable aux activités opérationnelles", ajoute-t-elle.
Message complété le 24/09/2024 14:44:14 par son auteur.
|
Répondre
|
Crossject publiera ses résultats financiers du premier semestre et organisera un webcast le 23 Septembre 2024
Dijon, France, 17 septembre 2024 - Crossject (ISIN : FR0011716265 ; Euronext : ALCJ), société pharmaceutique spécialisée dans le développement de médicaments pour les situations d'urgence exploitant son auto-injecteur sans aiguille primé ZENEO®, publiera ses résultats financiers pour le semestre clos le 30 juin 2024, comme prévu le lundi 23 septembre.
En outre, à 18h00 CET ce jour-là, le PDG Patrick Alexandre commentera les priorités stratégiques de l'entreprise au cours d'un webcast et répondra aux questions du public.
Marianne Svensson, directrice administrative et financière, sera également présente lors de l'appel. Pour vous inscrire au webcast, veuillez utiliser les coordonnées suivantes :
https://us06web.zoom.us/webinar/register/WN_pdQiyctTTAeP2jw9J8OTlA
Un enregistrement sera disponible après l'événement. Le webcast se déroulera en français.
|
Répondre
|
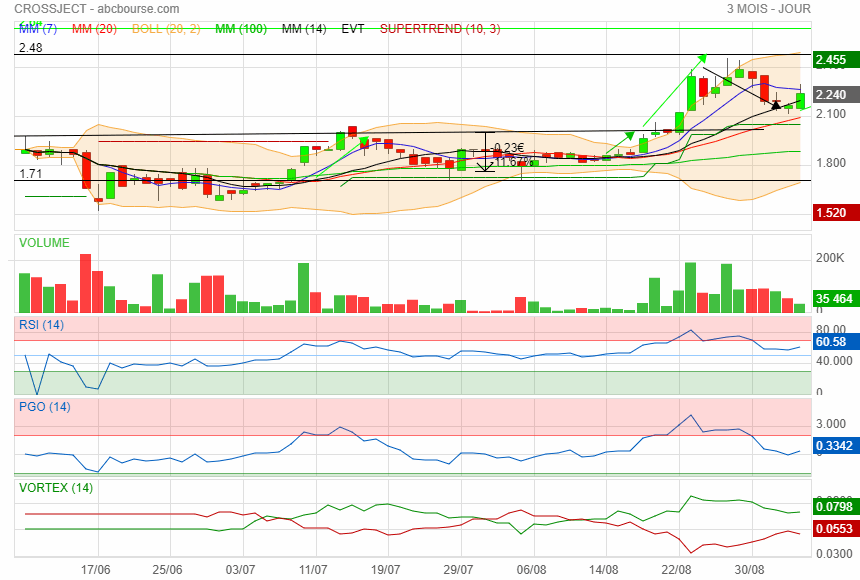
Gap de 2.12 -2.13 refermé
|
Répondre
|
Bonjour,
Attiré par le gap de 2.13 y a du monde qui attend à ce niveau .
Perso je viens dans reprendre à 2.19
Bons trades
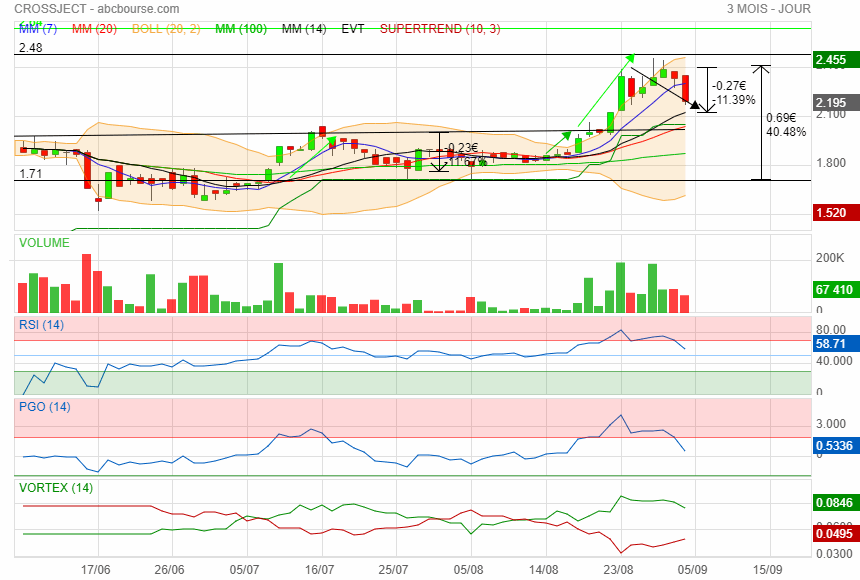
|
Répondre
|
on se rapproche des 2.5
perso j ai allégé la mule
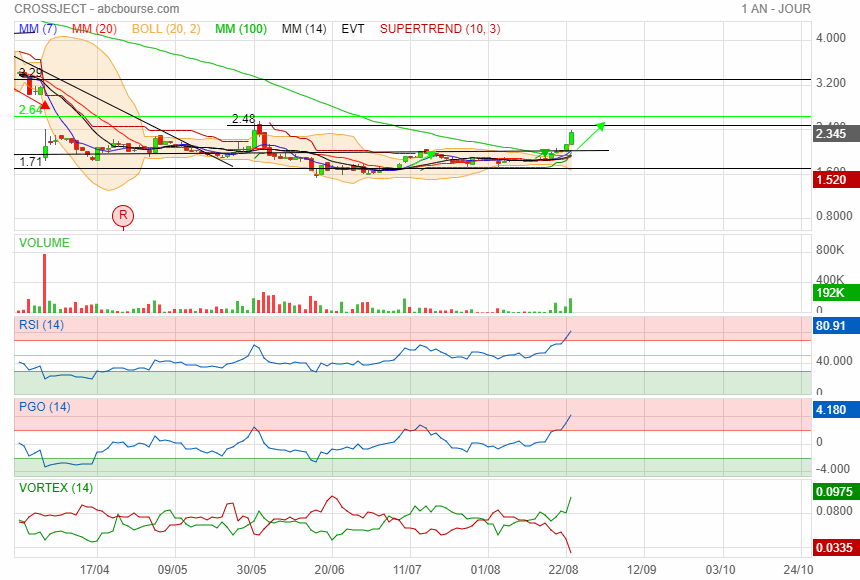
|
Répondre
|
Crossject participera à la 26ème Annual Global Investment Conference de H.C. Wainwright, 9 au 11 septembre 2024 et prendra part à des réunions individuelles avec des investisseurs lors de la 26e Conférence Annuelle sur l'Investissement Global organisée par H.C. Wainwright, qui se tiendra au Lotte New York Palace Hotel à New York, du 9 au 11 septembre 2024.
La présentation de Crossject sera disponible à la demande à partir du lundi 9 septembre à 7h00 (ET) via la plateforme de la conférence et sera également accessible via le lien de webcast suivant : <a href="https://journey.ct.events/view/806a8913-e050-4e66-8b56-d332674e52c0">https://journey.ct.events/view/806a8913-e050-4e66-8b56-d332674e52c0</a>.
Une rediffusion de la présentation sera disponible pendant 90 jours après l'événement sur le site web de Crossject à l'adresse <a href="http://crossject.com">crossject.com</a>.
La Conférence Annuelle sur l'Investissement Global de H.C. Wainwright est un événement prestigieux qui réunit un large éventail de leaders de l'industrie, d'entreprises innovantes, d'investisseurs institutionnels et de leaders d'opinion du monde entier. Cette conférence offre une plateforme dynamique permettant aux entreprises, en particulier dans les secteurs de la santé, de la biotechnologie et des sciences de la vie, de présenter leurs stratégies, leurs développements révolutionnaires et leurs perspectives futures à un public d'investisseurs potentiels et de pairs de l'industrie.
|
Répondre
|
les 2 sont la
maintenant prochaine résistance 2.5
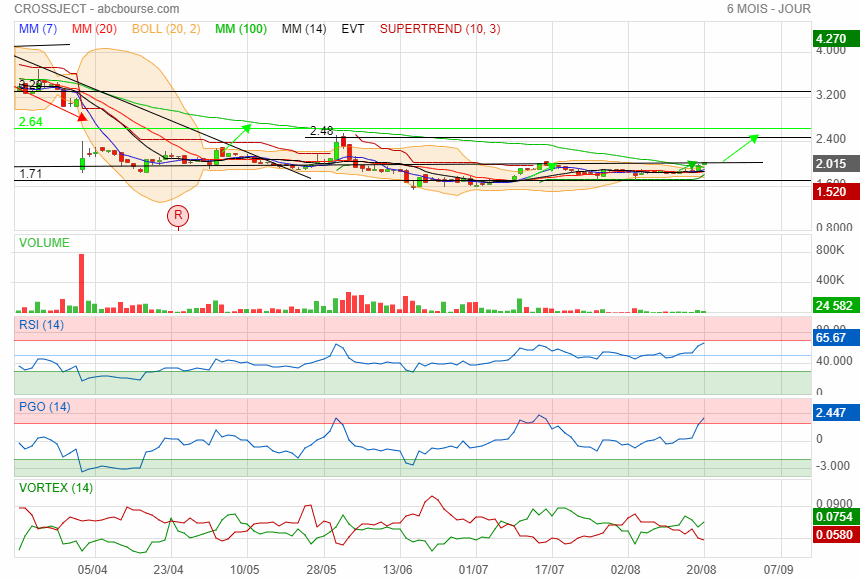
|
Répondre
|
Crossject : Tony Tipton chargé de déployer le remède anti-épilepsie aux Etats-Unis
Actualité publiée le 19/08/24 17:52
|
Répondre
|
les 2 sont pas loin !
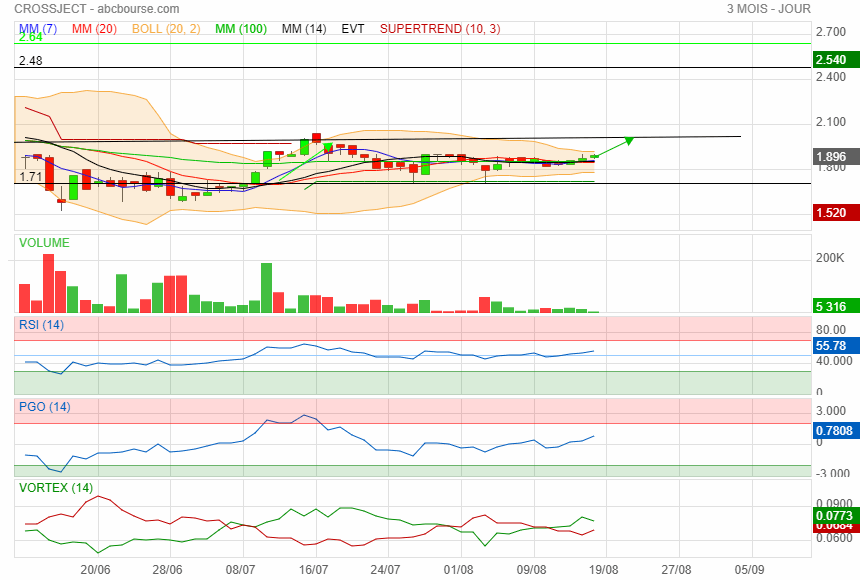
|
Répondre
|
Crossject franchit une nouvelle étape clé dans la fabrication de ZEPIZURE®
Le 18 juillet 2024
Fabrication réussie d’un autre Lot Règlementaire de ZEPIZURE® sur le nouveau site de fabrication
Une étape importante qui complète les résultats satisfaisants obtenus avec les lots précédents dans le cadre des études de stabilité, et qui s'inscrit dans la continuité des données de fabrication positives générées depuis 2021
Une étape dans la fabrication qui contribuera au succès de la procédure d’urgence (EUA) de la FDA conformément au plan de marche
Dijon, France, le 18 juillet 2024, 07:30 CET -- Crossject (ISIN: FR0011716265; Euronext: ALCJ), société pharmaceutique de spécialités en phase avancée de développement réglementaire de ZEPIZURE®, traitement d’urgence dans la prise en charge des crises d’épilepsie basé sur l’auto-injecteur sans aiguille primé ZENEO®, annonce l'achèvement avec succès d'un nouveau lot règlementaire de ZEPIZURE® dans les installations qualifiées d'Eurofins. Eurofins est désigné comme le partenaire CDMO qui assurera les activités de remplissage et l’assemblage final pour les livraisons à la Biomedical Advanced Research and Development Authority (BARDA*) des États-Unis.
Cette étape fait suite à un lot précédent produit sur le même équipement de remplissage en décembre 2023, qui avait donné de bons résultats et fait partie du programme de fabrication de divers lots sur le site commercial, visant à confirmer notamment la durée de péremption de ZEPIZURE®. Ces nouvelles avancées sont en ligne avec les précédentes données de stabilité à long terme.
Les lots de fabrication sont des éléments essentiels du dossier qui sera soumis à la FDA en relation avec la demande d’autorisation de ZEPIZURE® dans le cadre de sa procédure d’urgence (EUA). Combinés à notre prochaine étude de bioéquivalence aux États-Unis, ils constitueront aussi une pièce centrale de nos futurs dossiers de demande d'autorisation de mise sur le marché (NDA) à partir de 2025.
L'achèvement de ce lot d'enregistrement ouvre maintenant la voie à la collecte de nouvelles données qui démontreront davantage la qualité des produits fabriqués avec le nouvel équipement et assureront son adéquation réglementaire à une large utilisation commerciale, débutant avec sa livraison au Strategic National Stockpile américain. Crossject anticipe ses prochaines étapes avec la FDA concernant l'autorisation selon la procédure d’urgence (EUA) de ZEPIZURE® dans l’état de mal épileptique pour le T1 2025.
Patrick Alexandre, CEO of Crossject a déclaré « Nous sommes très satisfaits des progrès réalisés dans la mise en place d'un nouveau partenaire CDMO, augmentant nos capacités de remplissage et d’assemblage final pour ZENEO®. La production réussie de ce nouveau lot réglementaire, ainsi que des lots précédents, témoigne du travail acharné et du dévouement des deux équipes au cours des 18 derniers mois. Au-delà de ZEPIZURE®, ces succès dans notre processus de fabrication, notre dossier réglementaire et l’expansion de nos capacités industrielles ont une vraie valeur stratégique pour Crossject. Ils constituent une première étape concluante dans le plus large déploiement de notre technologie ZENEO® dans l'épilepsie et dans les autres indications de notre pipeline.”
|
Répondre
|
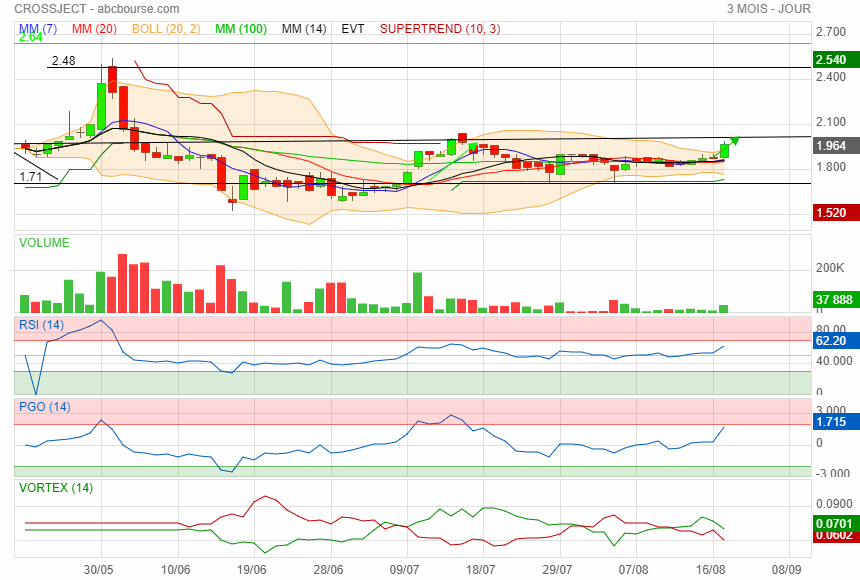
Graphique a chaque fois qu' elle est repartie du support de 1.71 elle avait fait un beau parcours perso j ai mis une sacoche de plus à la mule.
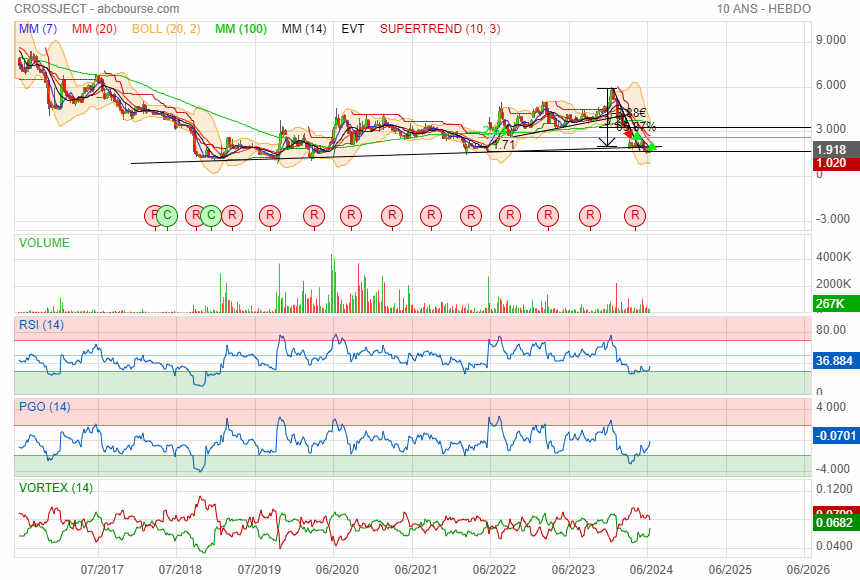
|
Répondre
|
@philiberts,
Merci beaucoup !
Une réaction du cours un peu timide (?) dans des volumes supérieurs à la moyenne ...
|
Répondre
|
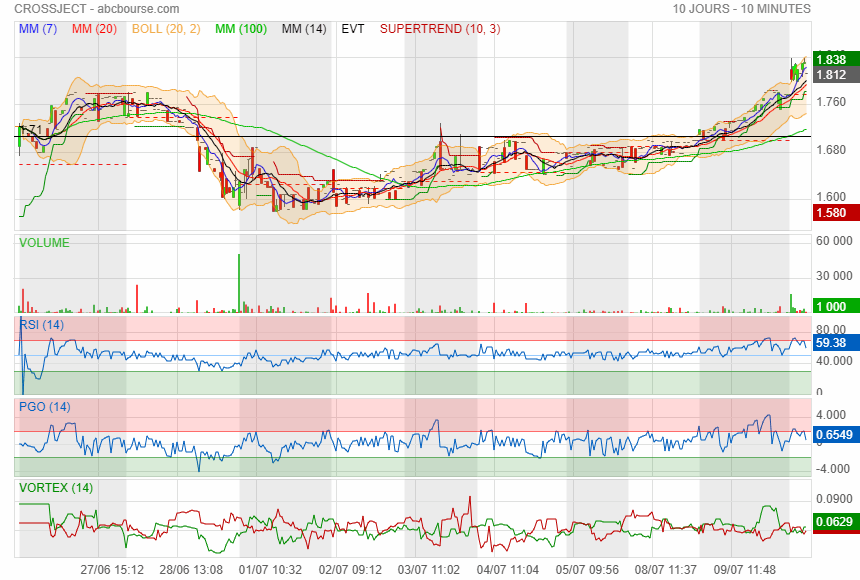
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !